용액의 농도 (1)
안녕하세요^^
용액의 농도에 대한 이론을 올렸으니 문제를 보도록 할게요^^
2023.02.07 - [고등화학 1] - 화학 1단원 용액의 농도
화학1단원 용액의 농도
안녕하세요^^ 오늘은 화학 1단원 마지막 파트인 용액의 농도에 대해서 정리를 하겠습니다. 용액의 농도에는 퍼센트 농도(%), 몰 농도(M or mol/L) 외 ppm, 몰랄농도등 다양하게 있습니다. 화학 1에서는
kblue77.tistory.com
첫 번째 문제를 볼까요??

0.5M NaOH 수용액을 만드는 과정에 대한 문제이네요. 우리가 만들려고 하는 용액의 부피는 1L가 아닌 500ml이라는 점 명심하세요^^ 그럼, 필요한 NaOH의 질량을 구해야 하는데, 몰 농도는 용질의 양(mol)/ 용액의 부피(L)이죠. 따라서 용질의 양(mol) = 용액이 몰 농도(M) X 용액의 부피 (L)로 구할 수 있습니다. 우리가 만들려고 하는 0.5M NaOH 수용액 500ml에 들어가는 용질의 양(mol) = 0.5M X 0.5L = 0.025 mol이네요. 0.025 mol의 질량을 알려면 NaOH의 화학식량이 필요합니다. NaOH의 화학식량이 40이므로 0.025mol의 질량은 40 X 0.025 = 1g이네요. NaOH 1g을 측정한 다음 비커에 넣고 물로 섞어 줍니다. 그리로 500ml 부피 플라스크에 녹인 NaOH를 넣은 다음 표선까지 물을 채워주고 뚜껑을 막고 섞어주면 끝입니다. 정답 찾으셨나요???
두 번째 문제입니다.
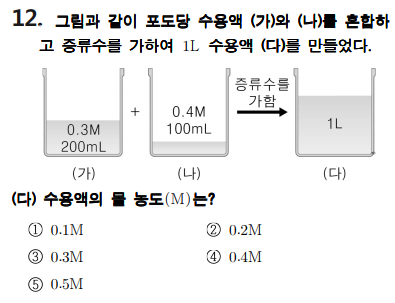
포도당 수용액 (가)와 (나)를 혼합하여 1L 포도당 수용액 (다)를 만들려고 하는 문제이네요. (다) 수용액의 몰 농도를 구하려면 우선, 전체 용질의 양(mol)을 계산해야겠죠? 그리고 부피는 (가)와 (나) 섞은 다음 증류수로 1L까지 채웠으니 용액의 총부피는 1L입니다. 그럼 용질의 양만 계산하면 쉽게 풀 수 있는 문제입니다.
용질의 양(mol)은 용액의 몰 농도(M) X 용액의 부피 (L)로 계산하면 되므로, (가)의 용질의 양은 0.06 mol, (나)의 용질의 양은 0.04 mol이므로 전체 용질의 양은 0.1 mol이네요.
혼합한 용액의 몰 농도는 용질의 양(mol) / 용액의 부피 (L) 이므로 0.1 mol / 1L = 0.1M입니다.
이상 조금은 쉬운 문제를 풀어봤습니다. 수능에서는 이것보다 조금 더 어려운 문제들이 출제가 되는데, 기본이 있어야 어려운 문제를 풀 수 있겠죠?? 기본을 다지는 계기가 되었으면 합니다.^^