중2과학 6단원 물질의 특성 - 용해도 (용해, 용액, 용매, 용질)
물질의 특성은 물질만이 가지고 있는 고유한 성질이죠. 물질의 특성에는 밀도, 끓는점, 녹는점(어는점), 용해도, 겉보기 성질이 있죠. 겉보기 성질, 밀도, 끓는점, 녹는점(어는점)에 대해서 포스팅을 했습니다. 물질의 특성 마지막인 용해도에 대해서 2편으로 첫 번째는 용해도에 들어가는 용어 및 퍼센트 농도에 대해서 알아보겠습니다.
2023.09.14 - [중등과학문제/중2 과학이론] - 중2과학 6단원 물질의 특성 - 밀도
중2과학 6단원 물질의 특성 - 밀도
물질의 특성은 특정물질만이 가지고 있는 고유한 성질을 말합니다. 물질의 특성에는 겉보기 성질, 밀도, 끓는점, 어는점, 용해도가 있습니다. 겉보기 성질을 앞에서 정리를 했으니까, 읽어보세
kblue77.tistory.com
2023.09.15 - [중등과학문제/중2 과학이론] - 중2 과학 6단원 물질의 특성 - 끓는점
중2 과학 6단원 물질의 특성 - 끓는점
6단원에 대한 내용 중 물질의 분류, 물질의 특성 중 겉보기성질, 밀도에 대해서 알아봤습니다. 최대한 쉽게 설명하고 있는데 많은 도움이 되었으면 합니다. 물질의 특성 세번째는 끓는점입니다.
kblue77.tistory.com
2023.09.16 - [중등과학문제/중2 과학이론] - 중2과학 물질의 특성 - 녹는점과 어는점
중2과학 물질의 특성 - 녹는점과 어는점
오늘은 녹는점과 어는점에 대해서 알아보도록 하겠습니다. 녹는점과 어는점 들어본 적 있나요? 못 들어봐도 많이 봤던 현상 중의 하나이요. 여름에 아이스크림을 먹을 때 분명히 고체였지만 시
kblue77.tistory.com
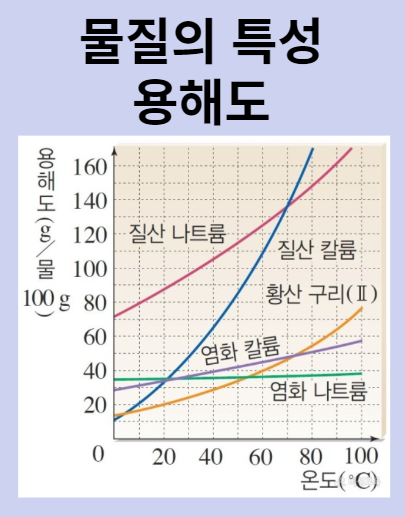
용해도
용해도는 용매 100g에 최대한 녹을 수 있는 용질의 g수를 말합니다.
그런데 용매, 용질... 들어보셨나요?? 용해도를 배우기 전에 꼭 알아야 하는 용어가 있습니다. 용어정리를 하고 넘어갈까요?
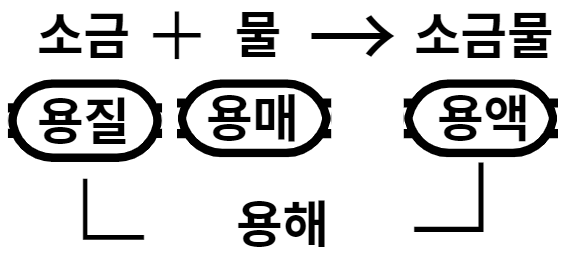
용매, 용질, 용액, 용해
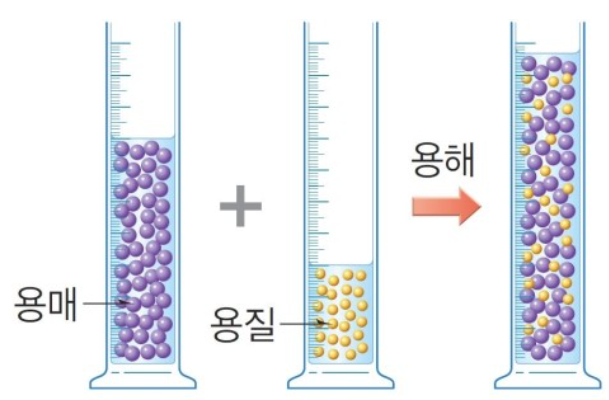
용매는 녹이는 물질, 용질은 녹는 물질을 말합니다. 예를 들면 소금과 물을 섞으면 소금이 녹고, 물은 소금을 녹이죠? 물처럼 다른 물질을 녹이는 물질이 용매, 소금처럼 녹는 물질을 용질입니다. 용매와 용질을 섞으면 용액이 됩니다. 용매와 용질이 섞으면서 용액이 되는 현상을 용해라고 합니다.
용액의 이름
용액에 이름을 부를 때는 용질을 먼저 용매는 나중에 부릅니다. 소금과 물을 섞으면 소금물이 되는데, 다르게 부를 수도 있어요. 소금은 염화나트륨이죠. 물의 한자는 수(水)이므로, 염화나트륨 수용액이라고 합니다. 용매가 물인 경우 ( ) 수용액이라고 합니다. 수용액으로 끝나는 용액에서 용매는 물이라는 것을 알 수 있습니다.
용매와 용질을 섞은 용액의 질량 및 부피는?
용매와 용질을 섞은 용액의 질량은 변하지 않습니다. 왜? 질량은 입자수입니다. 용매 100g과 용질 10g을 섞었다면 용매 100g에는 100g에 해당하는 입자수가 들어 있다는 것이고, 용질 10g에도 10g에 해당하는 입자수가 들어 있다는 것이죠. 따라서 용매와 용질을 섞었다고 입자수가 줄어들거나 많아지거나 변하지 않기 때문에 질량에는 변하지 않습니다. 하지만, 부피는 변합니다. 왜? 용매와 용질이 같은 물질이 아니므로 각각의 입자의 크기가 달라죠. 따라서 큰 입자 사이사이에 작은 입자가 들어가기 때문에 부피는 섞기 전과 섞은 후 달라지게 됩니다.
용액의 농도(퍼센트 농도)
용액의 농도를 구하는 방법에는 여러가지 있죠. 중학교에서는 퍼센트 농도(%)만 배우고 있습니다. 퍼센트 농도는 질량 백분율이라고 하는데요, 용매와 용질의 질량을 가지고 계산을 하는 방식입니다.

용액의 종류
용액에는 3가지 종류가 있습니다. 포화 용액, 과포화 용액, 불포화 용액으로 어떤 온도 일정한 용매에 용질이 가득 녹은 상태로 더 이상 녹을 수 없는 상태가 포화용액, 용질이 더 녹을 수 없는데, 더 녹아서 밑에 용질 일부가 녹지 않는 상태를 과포화용액, 용질이 용매에 더 녹을 수 있는 상태를 불포화 용액이라고 합니다.

그래프에서 A와 C는 용해도 곡선에 있으므로 포화용액이고, B는 용질이 더 이상 녹을 수 없고, 용질이 초과된 과포화 상태, D는 용질이 더 녹을 수 있는 상태로 불포화 공간입니다.
이상 용해도 보기전 용해, 용매, 용질, 용액, 퍼센트 농도에 대해서 알아봤습니다. 다음 시간에는 용해도 두 번째 시간을 갖도록 하겠습니다.