화학1단원 용액의 농도
안녕하세요^^
오늘은 화학 1단원 마지막 파트인 용액의 농도에 대해서 정리를 하겠습니다.
용액의 농도에는 퍼센트 농도(%), 몰 농도(M or mol/L) 외 ppm, 몰랄농도등 다양하게 있습니다. 화학 1에서는 퍼센트 농도와 몰 농도만 교과과정에 있습니다.

1. 퍼센트 농도 (%)
- 중학교 때 배웠죠?? 수학시간이나 과학시간에 농도에 대해서 배웠는데, 그 때 사용하는 농도입니다. 퍼센트 농도의 정의는 용액 100g에 녹아 있는 용질의 질량(g)을 백분율로 나타낸 것으로 단위는 %입니다.
퍼센트 농도 = 용질의 질량 / 용액의 질량 X 100으로 구합니다.
간략하게 용액이란 두 종류 이상의 순물질이 균일하게 섞여 있는 혼합물을 말하고, 용질은 녹는 물질, 용매는 녹이는 물질을 말하죠. 즉, 용액은 용질과 용매를 섞은 혼합물이라고 보면 됩니다. 예를 들면 소금과 물을 섞으면 소금이 물에 녹죠. 그러므로 소금은 용질, 물은 용매, 소금물은 용액이 됩니다.
10% 소금물 100g 이 있다고 하면 농도가 10%이고, 소금물(용액)이 100g 있다는 것이죠? 그럼 소금(용질)은 얼마일까요? 10g이라는 것 금방 알 수 있습니다. 이런 문제는 중학교 수학시간 또는 과학시간에 많이 보셨을 것이죠? 화학 1이라고 크게 다른 것은 없습니다. 다만, 퍼센트 농도에 몰의 개념이 추가가 되어서 문제가 나오는 것이죠.
예를 들면 10% 포도당 수용액 100g 이 있다고 할게요. 포도당은 몇 g을 녹이면 될까요? 이렇게 물어보면 중학교 수준이고, 포도당을 몇 몰 녹이면 될까요? 이렇게 물어보면 고등학교 화학 1 수준입니다.
같이 볼까요? 10% 포도당 수용액 100g 이므로 포도당(용질)이 10g 들어가면 되겠네요^^그렇죠? 여기까지 중학교 수준이라고 했습니다. 그럼, 포도당 10g은 몇 몰일까요? 포도당의 분자량은 180이에요^^(포도당의 분자식 C6H12O6이에요^^. 포도당의 분자량은 시험문제에 주는 경우도 있겠지만, 알고 있으면 좀 더 문제를 빨리 풀 수 있겠죠??) 포도당의 분자량이 180이므로 1 mol 일 때 포도당의 질량은 180g이 됩니다. 그럼, 10g은 몇 몰일까요? 10/180 mol 이네요. 이해가 되시나요?? 여기서 포도당의 분자수는 몇 개 있어야 하나요? 이렇게 물어볼 수도 있습니다. 1mol일 때 분자의 개수는 6.02 X 10의 23승 이죠. 그럼, 10g일 때 몰수는 10/180 mol 이므로 10/180 X 6.02 X10^23(10의 23승 아시죠?) 이렇게 이야기하시면 됩니다.
중학교 과학에서 계산보다 좀 더 복잡하다고 보면 됩니다. 그리고 숫자도 지저분해 보이시죠???
이처럼 중학교 과학보다 좀 더 난이도가 올라간다고 보면 되죠.
그럼, 일상생활에서 어떻게 사용하나요?? 혹시 링거 맞은적 있으세요?? 링겔 맞을 때 주사액이 들어 있는 비닐봉지(??)에 문구를 보시면 5% 포도당 수용액이라고 적혀 있죠. 또 식초에도 몇 %라고 등등 많이 사용하고 있습니다.
2. 몰 농도(M or mol/L)
처음 들어보는 농도인 분 맞죠?? 일상생활에서 보다는 실험실에서 사용하는 단위라고 보면 됩니다.
몰 농도의 정의는 용액 1L 속에 녹아 있는 용질의 양(mol)으로, 단위는 M or mol/L로 나타냅니다.
몰 농도 = 용질의 양(mol)/용액의 부피(L)로 구합니다.
예를 들면 1M 수산화나트륨(NaOH) 수용액 1L에는 수산화나트륨이 몇 몰 있을까요? 1M이란 용액 1L 속에 녹아 있는 용질의 양(mol)이므로 수산화나트륨은 1몰 있다고 하면 됩니다.
이렇게 간단하게 물어보면 좋겠지만, 아니에요. 1M 수산화나트륨수용액 1L를 만들고 싶다면 수산화 나트륨이 몇g이 필요한가? 또는 0.1M 수산화 나트륨 0.1L에 들어 있는 수산화 나트륨 입자수와 0.1M 수산화 바륨 0.1L에 들어 있는 입자수는 비교하면... 등등 퍼센트 농도보다 좀 더 고차원적으로 물어볼 수 있습니다.
간단한 문제를 보면, 0.1M 수산화나트륨 수용액 500ml를 만들기 위해서 필요한 수산화 나트륨의 질량을 구한다면 어떻게 할까요? 몰 농도는 용질의 양(mol)/용액의 부피(L)이므로 0.1M = 용질의 양(mol)/용액의 부피(0.5L) 이므로 용질의 양은 0.05몰이죠. 그럼, 수산화 나트륨 0.05몰의 질량은 구하면 되겠네요. 수산화 나트륨 화학식량이 40이므로 1몰이면 40g이죠. 0.05몰이면 2g만 있으면 되겠네요. 이해가 되시나요??
몰농도를 구하는 문제뿐만 아니라, 만드는 방법도 같이 물어보는데요~~
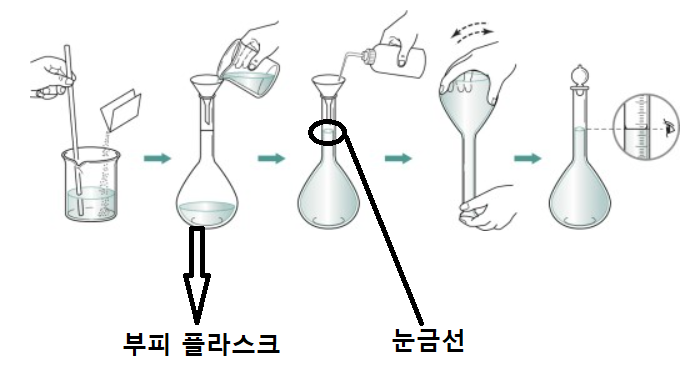
몰 농도를 만드는 방법은 우선, 용질의 질량을 측정한다.(당연히 몰로 측정을 해야겠죠?) 두 번째, 비커에 용질과 소량의 물을 같이 넣어서 섞어줍니다. 세 번째, 비커에 들어 있는 용액을 부피 플라스크에 넣고, 나머지는 물로 눈금까지 채워줍니다. 네 번째 부피 플라스크 마개를 닫고 흔들어 주면 끝입니다.
3. 용액을 묽힐 때 몰 농도
- 실험실에서 용액을 계속 만들 수 없기 때문에 보통 표준용액을 만들어서 사용하는데, 이 표준용액은 실험실마다 다르게 만들 수 있지만, 예를 들어 1M 수산화나트륨 수용액 1L를 만들었다. 근데, 내가 필요한 용액은 0.01M 수산화 나트륨 수용액 0.2L가 필요하다면 표준용액을 가지고 묽혀서 사용한다. 이때 묽히는 방법에 대해서 알아보도록 할게요.
진한 용액을 묽힐 때 용액에 녹아 있는 용질의 양(mol)은 변하지 않는 것을 이용하여 만들면 된다.
용질의 양(mol) = 몰 농도(M) X 용액의 부피(L)
진한 용액의 몰 농도 X 진한 용액의 부피 = 묽힌 용액의 몰 농도 X 묽힌 용액의 부피 이렇게 되어야 한다. 왜?? 용액의 묽힌다는 것은 용액의 부피만 변하기 때문이다.
간단한 예를 들면, 0.01M 포도당 수용액 0.5L를 만들 때 필요한 0.1M 포도당 수용액의 부피는??
0.01M 포도당 수용액 0.5L에 들어 있는 포도당 용질의 양과 0.1M 포도당 수용액 xL에 들어 있는 용질의 양은 같아야 하므로 0.01M X 0.5L = 0.1M X xL 공식을 세워서 x를 풀면 0.05L가 나온다. 따라서 0.1M 포도당 수용액 0.05L를 묽히면 0.01M 포도당 수용액 0.5L가 된다.
이해가 되는지요??
4. 서로 다른 농도의 용액을 혼합했을 때 몰 농도
- 같은 용질이 용해된 다른 농도의 혼합물을 섞었을 때 두 용액의 혼합물의 농도는 어떻게 될까??? 예를 들면 10% 소금물 100g과 20% 소금물 200g 섞으면 소금의 전체 양은 변할까?? 안 변하죠. 다른 몰 농도의 용액을 섞어도 전체 용질은 변하지 않습니다. 부피만 변하죠. 이해가 되시나요??
용질의 질량(mol) = 용액의 몰 농도 (M) X 용액의 부피(L) 이렇게 구하죠.
aM A 수용액 V1 L와 bM B 수용액 V2 L를 섞었을 때 전체 용액의 농도를 구하면 다음과 같다.
용질의 전체 질량은 (aM X V1 L) + ( bM X V2)이고, 혼합용액의 부피는 V1 + V2 이므로 몰 농도는
{(aM X V1 L) + ( bM X V2)} / (V1 + V2)이다.
기호로만 작성하니 이해가 되시나요??
간단하게 문제 볼게요^^
0.1M 수산화나트륨 수용액 100ml와 0.2M 수산화 나트륨 수용액 200ml를 혼합하면 몰 농도는 어떻게 될까요?
우선, 전체 부피는 300ml이죠. 그럼, 용질의 양을 구하면 되는데, 0.1M 수산화나트륨 수용액 100ml에 들어 있는 수산화나트륨은 0.1M X 0.1L = 0.01몰이고, 0.2M 수산화 나트륨 수용액 200ml에 들어 있는 수산화 나트륨은 0.2M X 0.2L = 0.04몰이다. 따라서 전체 용질은 0.01몰 + 0.04몰 이므로 0.05몰이죠.
용질의 양과 전체 부피를 알았으니 혼합한 용액의 몰 농도는 0.05 mol / 0.3L = 0.5/3 약 0.17M이 된다.
이론만 보면 어려운 문제는 별로 없어 보이지만, 문제를 보면 확연히 다르다는 것을 느낄 수 있을 것이에요~~
저도 대학에서 화학을 배울 때 실험을 할 때는 좋지만, 계산하는 것 별로라서 ㅋㅋㅋ
암튼, 화학 1 단원 마지막 파트 였습니다.^^ 학교 기출문제로 올리도록 하겠습니다.^^
긴 글 읽어주셔서 감사합니다. ^^