화학1 몰이란??
오늘은 화학 1 1 단원중 몰에 대해서 정리하도록 하겠습니다.
몰이란?
몰이 무엇일까??? 몰은 쉽게 말해서 묶음 단위라고 보시면 됩니다. 왜 이런 묶음 단위를 사용할까요??
몰을 설명하기 전에 원자에 대해서 간략하게 보죠.
지구상에 존재하는 원소는 92개(우라늄까지)는 자연에서 나머지는 인공적으로 만든 원소입니다. 원소와 원자는 조금 다른데, 원자는 원소 안에 있는 알갱이 하나하나를 말하고, 원소는 원자 알갱이를 묶어서 이야기하는데요, 정확하게 정의를 보면, 원소는 물질을 이루는 기본적인 성질, 원자는 물질을 이루는 가장 작은 입자 라고 합니다. 이해가 되시나요??
쉽게 말을 할께요^^
몰 예시
한 초등학교에서 1학년 1반이 있습니다. 1반에는 총 20명의 학생이 있다고 할게요. 그리고 그 초등학교 1학년에는 총 5개 반이 있다고 하겠습니다.
자 시작을 할께요. 1반부터 5반까지는 구성원이 다르겠죠? 1반에 20명 학생이 있는데, 학생 하나하나를 입자라고 생각하면 1반에는 총 20개의 입자가 있다는 것이죠. 이런 입자의 합이 원소이고, 입자 하나하나가 원자가 됩니다.
수소원소에는 총 3가지 수소원자가 있습니다. 질량이 1인 수소, 질량이 2인 수소, 질량이 3인 수소가 있는데, 화학적 성질은 다 같아요. 성질이 같은데 다른 원소라고 할 수는 없겠죠? 질량 1, 2, 3인 모든 수소를 합치면 수소원소가 되는 것이고, 질량이 1~3까지 각각 하나씩을 수소원자라고 하면 됩니다. 이해가 되시나요??
따라서 초등학교 1~5반까지 하나의 반은 전혀 다른 성질을 갖고 있으므로 원소가 되는 것이고, 반 전체 학생수는 하나의 입자로 원자로 보시면 됩니다.
원자의 크기
그럼 원자의 크기는 얼마할까요? 엄청 작습니다. 원자 하나를 탁구공만큼 확대를 했다고 할게요. 그럼 실제 탁구공으로 확대를 하면 크기가 지구가 됩니다. 엄청 작아요. 질량도 엄청 작겠죠??? 크기가 가장 작은 원자가 수소원자인데, 지름이 10의 마이너스 10 미터로 예상하고 있습니다. 약 백억분의 1미터라는 것이죠. 그럼 질량도 너무 작아서 측정을 하기가 정말로 어렵습니다. 근데, 화학을 할 때 질량을 측정을 해야 하는데, 원자 한 개의 질량이 워낙 작아서 한 개의 질량으로 실험하기에는 무리가 있겠죠?? 그래서 원자를 묶어서 질량을 측정합니다. 이때 묶어서 재는 단위를 몰이라고 합니다.
이해가 되시나요???
1몰이란 원자량이 12인 탄소 원자(12C) 12.0g에 해당하는 탄소 원자(12C)수로 정의합니다. 계산을 하면 6.02X10^23 개수가 되고 이 수를 아보가드로수(NA)라고 합니다.
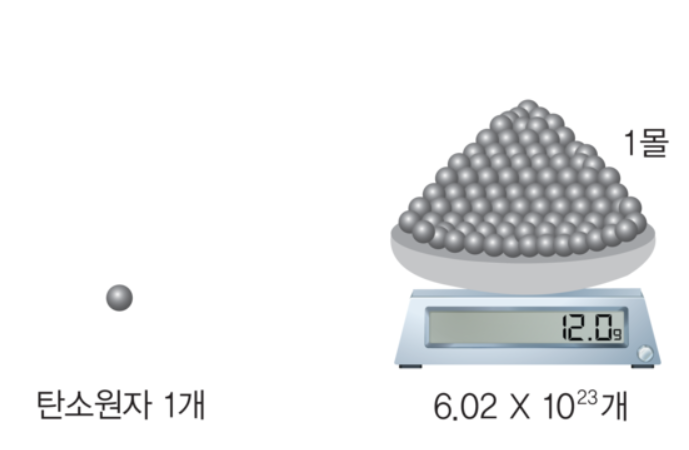
1몰이란?
다시 정리를 하자면 1몰이란 6.02X10^23 개의 입자(원자, 분자, 이온)수를 말합니다.
그럼 원자 0.5몰하면 1/2X6.02X10^23가 되겠죠??
물분자 화학반응식 기억하시나요? 2H2 + O2 -> 2H2O 이렇게 되잖아요. 물분자 2개를 만들기 위해서는 수소분자 2개와 산소분자 1개가 있으면 된다. 중학교에서 이렇게 배웠다면 화학 1에서는 물분자 2몰을 만들기 위해서는 수소분자 2몰과 산소분자 1몰이 있으면 된다. 이렇게도 표현 가능합니다. 화학반응식에서 계수는 분자수도 되지만 몰수도 된다는 것이죠.
그럼 이렇게 모인 1몰의 질량을 어떻게 계산할까??? 바로 화학식량으로 계산합니다. 화학식량은 무엇일까? 화학식량은 물질을 이루는 원자, 분자, 이온들의 상대적인 질량의 합입니다. 예를 들면 물분자이면 화학식은 H2O이죠? 수소 원자의 원자량은 1, 산소의 원자량은 16이에요. 그럼 물분자의 화학식량은 수소 원자의 원자량 X2 + 산소 원자의 원자량으로 18이 되겠네요. 염화나트륨(NaCl)은 분자로 구성된 물질이 아니에요. 그래서 분자량 대신 화학식량으로 표현을 하고 화학식량은 염화나트륨의 각 원자량의 합으로 구하면 됩니다.
갑자기 몰의 질량을 이야기 하는데, 화학식량이 왜 나올까요? 바로 원자 또는 분자, 이온 1몰의 질량은 그 원자, 분자, 이온의 화학식량의 g를 붙이면 되기 때문이다. 예를 들면 물 분자의 화학식량은 18이고, 1몰의 물분자 질량은 화학식량(분자량)에 g를 붙인 18g이 되는 것입니다. 염화나트륨 1몰이 있다면 질량은 얼마인가? 염화나트륨 화학식량(나트륨이온 원자량 23, 염화이온 원자량 35.5) 58.5이므로 염화나트륨 1몰의 질량은 58.5g이 되는 것이죠.
몰과 질량, 몰과 입자수, 몰과 부피
몰을 알면 그 물질의 질량을 알 수 있고, 질량을 알면 그 물질의 몰 수를 알 수 있네요.
다른 하나는 1몰에 해당하는 부피에요^^ 아보가드로 법칙에서 일정한 온도와 압력하에서 모든 기체는 같은 부피 속에 같은 입자수를 가진다.라고 했으므로 1몰에 들어 있는 입자수는 6.02X10^23이고 어떤 기체든지 모든 22.4L에 들어 있다. 따라서 1몰의 부피는 22.4L라는 것이다. 부피를 알면 몰수를 알 수 있고, 몰수를 알면 부피를 알 수 있다는 것이다.
우리는 지금까지 1몰의 개념을 입자수, 질량, 부피로 알아봤다. 정리를 하자면 1몰의 입자수는 6.02X10^23이고, 1몰의 질량은 물질의 화학식량에 g를 붙이면 되고, 1몰의 부피는 22.4L 라고 할 수 있겠네요.
이런 관계식이 나타납니다.
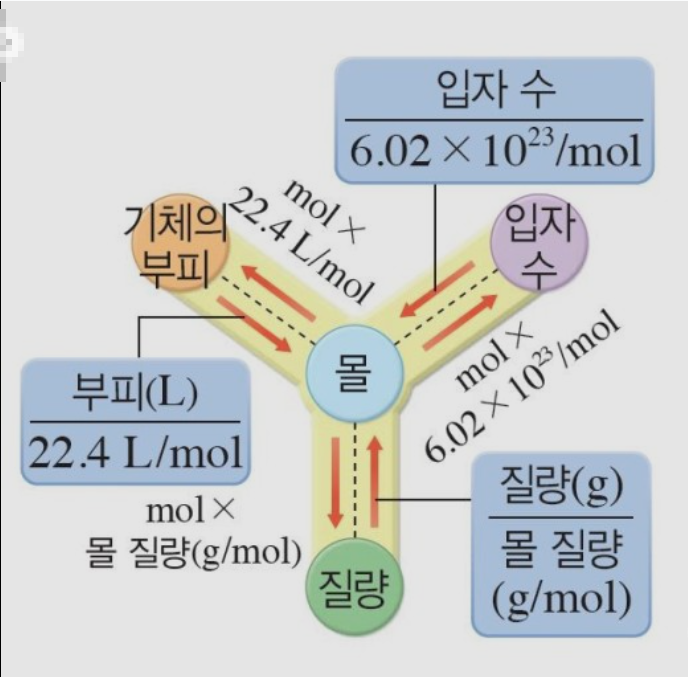
우리가 알아야 할 것은 몰을 부피 또는 질량, 입자수로 또는 반대로 변환을 할 수 있어야 한다는 것이다.
간단한 문제를 볼까요?

에테인 기체 15g은 몇몰일까요? 에테인의 분자량은 (탄소의 원자량 X 2 + 수소의 원자량 X 6) 30이므로 1몰은 30g이다. 15g은 0.5몰이네요. 이산화탄소 분자가 6 X10^23 이네요. 아보가드로수 6 X 10^23 이므로 이산화탄소 분자는 1몰 있습니다. 마지막으로 수소기체가 44.8L 있는데, 조건에서 1몰의 부피는 22.4L라고 했으니까 수소기체 44. 8L은 22.4L의 2배 이므로 2몰이네요.
그럼 정답 보이시나요??
이상 1단원에서 몰의 개념을 봤습니다. 이해가 되었으면 합니다.^^ 감사합니다.
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^
