화학1 원자 모형(돌턴의 원자모형부터 보어의 원자모형)
원자모형에 대해서 알아보도록 할게요^^
돌턴의 원자모형(공모형)
원자 모형을 처음으로 제시한 사람은 영국의 화학자 돌턴이죠^^
돌턴은 원자설을 발표했는데요~
원자설 첫 번째가 물질을 구성하는 원자는 더 이상 쪼갤 수 없는 구조라고 했죠. 돌턴의 원자모형이 나왔는데, 정말로 단순하게 표현하죠. 돌턴은 화학반응을 관찰하면서 더 이상 분해되지 않는 가장 단순한 기체를 이루는 입자를 생각하고, 이를 자연의 근본 단위로 생각하여 원자(atom)라는 이름을 붙였다. 이는 화학에 기반하므로, 화학반응이 잘 일어나지 않아 분해되지 않는 것처럼 보이는 기체도 원자 하나로 이루어져 있다고 생각하였다.

그러다가 톰슨이 음극선 실험을 통해서 전자를 발견하면서 돌턴의 원자 모형은 깨지기 시작했죠.
톰슨의 원자 모형(머핀모형)
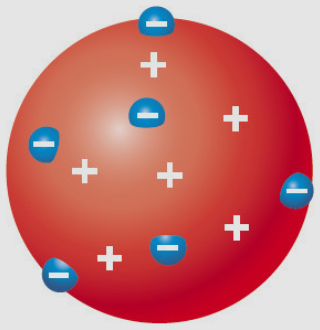
톰슨은 음극선 실험을 통해서 전자를 발견하고 원자는 원자핵과 전자로 구성되어 있다고 했다. 여기서 특이한 점은 전자가 원자핵 주변을 도는 것이 아니라 원자핵과 전자가 원자 주변에 박혀있는 모형으로 제시한 것이다. 이를 푸딩(머핀) 모형이라고 한다.
러더퍼드의 원자 모형(행성모형)
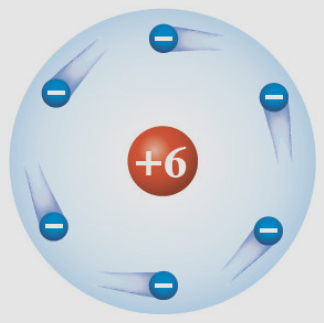
러더퍼드는 톰슨의 원자 모형을 실험으로 증명하기 위해서 알파입자 산란실험을 하다가 원자 중심부에는 원자핵이 있다는 것을 알게 되었고, 이를 계기로 전자가 원자핵 중심을 돌고 있는 모형(행성모형)을 제시했죠.
근데, 이 모형의 단점은 바로 전자가 원자핵 중심을 돌고 있는데, 입자가 돌고 있으면 에너지를 소비하게 되죠. 그러면 언젠가는 전자는 원자핵 쪽으로 점점 끌려가게 되죠. 왜? 처음에는 전자와 원자핵 간의 정전기적 인력과 전자의 가속도 운동에 의해서 열심히 원자핵 중심을 돌고 있지만, 전자가 계속 전자기파(일종의 에너지)를 방출하면 점점 정전기적 인력에 의해서 원자핵으로 끌려가게 되고 그러면 원자핵과 전자가 합쳐지면서 원자는 사라지게 되는 문제점이 발견됩니다. 두 번째는 전자가 원운동 하면서 전자기파를 방출하는데, 이 전자기파를 스펙트럼으로 분석하게 되면 전자기파를 끊임없이 방출하는데, 점점 방출하는 양이 적어지므로 연속 스펙트럼이 나와야 하는데, 측정결과 선 스펙트럼이 나오면서 모순이 생기는 것이 단점이었습니다. 이런 단점을 보완하기 위해서 나온 것이 바로 보어의 원자 모형이죠^^
보어의 원자 모형(궤도모형)
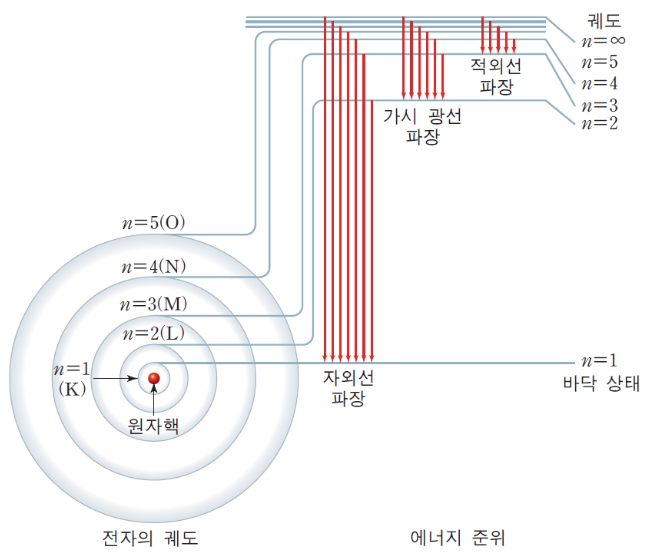
보어는 러더퍼드와 같이 원자 모형을 연구하다가 러더퍼드의 원자 모형이 물리적으로 불완전한 원자모형이라는 것을 제시하였다. 보어는 러더퍼드 원자 모형의 문제를 해결하기 위해 플랑크와 아인슈타인이 발전시키고 있던 양자화 가설을 원자 모형에 도입했는데 원자핵 주위를 돌고 있는 전자는 모든 에너지를 가질 수 있는 것이 아니라 띄엄띄엄한 값을 가지는 안정한 상태에만 존재할 수 있다고 가정한 것이다. 이렇게 안정한 상태에서 원자핵을 돌고 있는 전자는 전자기파를 방출하지 않고 따라서 에너지가 줄어들지도 않는다고 가정했다. 일정한 에너지를 가지는 이러한 안정된 상태를 에너지 준위라고 했다. 전자가 에너지를 얻거나 잃는 것이 아니라 두 에너지 준위의 차이에 해당하는 에너지를 한꺼번에 얻거나 잃어야 한다는 것이다. 전자는 빛을 방출하거나 흡수하여 에너지를 잃거나 얻는다. 이때 전자가 방출하거나 흡수하는 빛의 진동수는 ν라고 하고 플랑크 상수를 h라고 하면 다음과 같은 식이 성립한다.

여기서 E1, E2는 각각 전자가 건너뛰는 두 에너지 준위의 에너지이다. 하지만, 고전물리학적으로 설명이 불가능한 것이어서 그 당시에는 받아들이기 어려운 생각이었다.
고전물리학적으로 설명이 불가능한 보어의 원자 모형이 받아들이게 된 가장 큰 이유는 바로 수소기체의 스펙트럼 때문이죠. 19세기에는 여러 가지 원소들이 높은 온도에서 선스펙트럼이 나오는 것을 알고 있었죠.
1884년 발머는 수소 기체가 내는 가시광선에 해당하는 스펙트럼을 발견하였고, 후에 라이먼과 파셴은 각각 수소기체가 내는 자외선과 적외선 영역의 스펙트럼 계열을 발견하면서 보어는 자신의 새로운 원자모형을 이용하여 수소원자 내는 스펙트럼을 설명했죠. 보어는 "원자 모형에 의하면 원자핵 주위를 돌고 있는 전자 궤도는 원자핵에서 먼 궤도일수록 큰 에너지를 갖는다. 전자가 아래 궤도에서 윗 궤도로 가려면 에너지를 흡수해야 하고, 윗 궤도에서 아래 궤도로 떨어질 때는 빛의 형태로 에너지를 방출해야 한다."라고 하면서 자신의 원자 모형을 이용해 수소 원자가 내는 스펙트럼의 진동수를 설명했다.
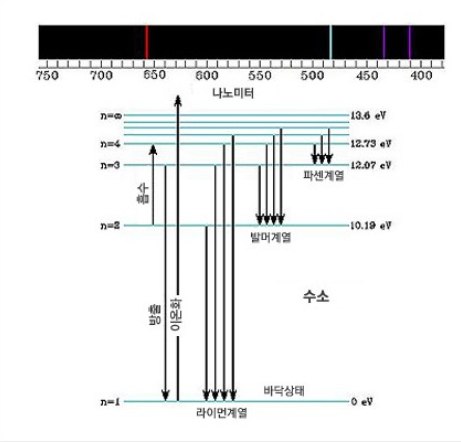
하지만, 보어의 원자 모형으로 설명할 수 있는 수소 말고는 다른 원소에서 적용할 수 없는 문제점이 발견되었다. 왜?? 수소는 전자가 1개밖에 없지만, 헬륨부터는 전자가 2개 이상이어서 전자 간의 척력이 작용하여 보어가 제시한 방정식에 적용이 안 되는 것이었죠.
이상 원자모형에 대한 포스팅이었습니다.^^
다음에는 현대적인 원자모형에 대해서 포스팅할게요^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^
