화학1 2단원 원자의 세계 기말고사 기출문제 -7
기말고사가 점점 다가오고 있네요. 준비는 잘 되어 가고 있으세요??
어제 수능에 대한 뉴스가 나와서 많이 혼란되고 있는 것으로 알고 있습니다. 킬러문항 배제... 참.. 어렵네요. 하지만, 우리는 지금 내신에 집중했으면 합니다. 흔들리지 마시고 힘내시기를~~~
기말고사 기출문제 풀이입니다. 풀이를 잘 읽어보시면 답이 보이기 때문에 정답은 따로 적지 않습니다. 그럼 시작하겠습니다.
유효 핵전하

문제풀이
유효 핵전하는 전자가 실제로 느끼는 핵전하를 말합니다. 핵전하는 핵이 띠는 전하를 말하는 것이죠. 유효 핵전하와 핵전하 차이 이해되시나요??
일반적으로 유효핵전하는 같은 주기에서 원자번호가 증가할수록 커집니다. 같은 주기이므로 전자껍질수는 같아요. 그래서 안쪽 전자들이 가려주는 효과는 같죠. 그러나 양성자수가 증가하기 때문에 유효핵전하는 증가 합니다.
같은 족에서는 어떻게 될까? 원자번호가 증가할수록 작아집니다. 왜? 같은 족이면 주기가 다르죠. 그러면 전자껍질수가 많아지므로 바깥쪽에 전자가 맨 뒤로 가게 되죠. 그러면 안쪽에 전자들이 가려주는 효과는 증가하므로 마지막 껍질에 있는 전자에 미치는 핵전하량은 작아지죠. 그래서 주기가 바뀔 때 유효 핵전하는 감소하게 되죠.
전자수가 같을 때는 어떻게 될까요? 전자수가 같으면 안쪽에 전자가 가려주는 효과는 동일하겠죠? 그럼 양성자의 수가 많을수록 유효 핵전하는 증가 합니다.
답 찾아보세요^^
주기율표
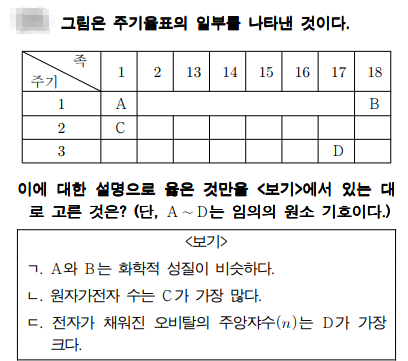
문제풀이
A ~ D까지 어떤 원소인지 아시나요?? A - H, B -He, C - Li , D - Cl 이죠.
주기율표에서 같은 족의 원소들은 화학적 성질이 비슷합니다. 이는 원자가 전자수 때문이죠.
원자가 전자수는 가장 바깥쪽에 있는 전자수 이죠. 쉽게 구하는 방법은 각 족에서 일의 단위가 원자가 전자수로 보시면 됩니다. 단, 18족은 원자가 전자수가 0이죠.
각 주기의 수는 주 양자수를 의미하면서, 전자껍질 수이기도 하고요~~
그럼 답 보이시나요??
원자 반지름과 이온 반지름
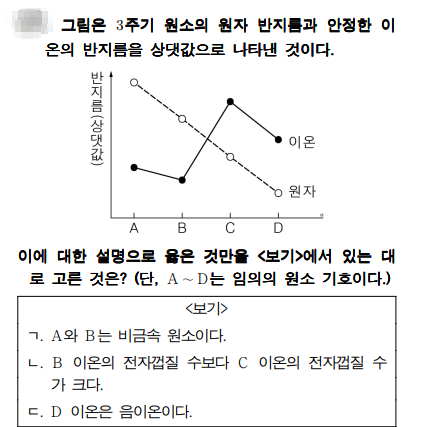
문제풀이
원자 반지름과 이온 반지름을 비교하면 그 원소가 금속원소인지 비금속원소인지 알 수 있습니다. 어떻게? 금속원소라면 원자 반지름이 이온 반지름보다 크죠. 왜? 금속원소가 이온이 되려면 가장 바깥쪽의 전자가 떨어져 나가면서 되죠. 그럼 전자껍질의 수가 줄어들게 되고, 양성자수는 원자일 때와 이온일 때 같기 때문에 이온 반지름이 원자 반지름보다 작아지게 됩니다.
그래프에서 A, B, C, D 중 금속 원소와 비금속 원소 구별이 가능한가요? A, B는 금속원소이고, C, D는 비금속원소라는 것 확인이 되시죠? 금속원소는 양이온이 되고, 비금속원소는 음이온이 되죠. 그러면 같은 주기라도 이온이 될 때 전자의 수가 다르죠. 그리고 전자껍질 수도 다르게 되죠. 이온이 되었을 때 양이온과 음이온 중 전자껍질수는 누가 더 많을까요? 같은 주기에서~~
답은 직접 찾아보세요^^
순차적 이온화 에너지
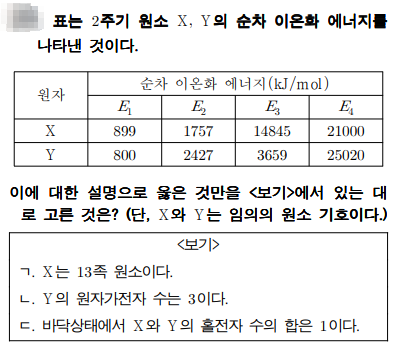
문제풀이
이온화 에너지는 전자 1개를 떼어낼 때 필요한 에너지를 말합니다. 순차적 이온화 에너지는 첫 번째 전자를 떼어내고, 두 번째, 세 번째, 네 번째.... 이렇게 차례대로 전자를 한 개씩 떼어낼 때 필요한 에너지를 말하죠. 이를 통해서 원자의 족과 원자가 전자수를 알 수 있습니다.
예를 들면 나트륨은 가장 바깥쪽에 전자가 1개 있죠. 그리고 두 번째 전자를 떼어내기 위해서는 첫 번째 전자 떼어낼 때 에너지보다 훨씬 큰 에너지가 필요합니다. 왜? 첫 번째 전자를 떼어내면 나트륨이온이 되면서 가장 바깥쪽 전자껍질에 전자 8개를 다 채운 옥텟을 만족하게 되죠. 안정한 상태가 되었죠. 그런데 전자 한 개를 더 떼어내기 위해서는 바깥쪽 껍질에 있는 전자 8개 중 한 개를 떼어내는 것이므로 많은 에너지가 필요합니다.
첫 번째 전자를 떼어낼 때를 제1 이온화 에너지, 두 번째 전자를 떼어낼 때를 제2 이온화 에너지, 세 번째, 네 번째... 제3 이온화 에너지, 제4 이온화 에너지.. 이렇게 나갑니다. 나트륨처럼 제 1이온화 에너지에 비해 제 2이온화 에너지가 급격하게 증가하는 경우를 토대로 나트륨에는 가장 바깥쪽에 전자가 1개만 있다는 것 알 수 있죠. 그리고 1족이라는 것도요~~
문제에서 X는 제 2이온화 에너지보다 제3 이온화 에너지가 훨씬 크죠. 이를 토대로 X는 2족 원소라는 것, 그리고 원자가 전자수는 2개라는 것을 알 수 있답니다. 그럼 Y는 제 4이온화 에너지가 급격하게 증가하므로 13족 원소라는 것을 알 수 있죠.
X는 2족, Y는 13족 이므로 홀전자 수는 각각 0개와 1개이죠. X와 Y가 2주기 원소이므로 X는 베릴륨, Y는 붕소이므로 전자배치를 이용하면 Be 1s2 2s2, B 1s2 2s2 2p1 이렇게 되네요^^
답 보이시죠??
이상 4문제에 대하여 문제풀이를 했습니다. 많은 도움이 되었으면 하네요^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^
