3월 모의고사 문제 및 해설 -2
2023.03.25 - [고등화학1] - 23년 3월 모의고사 문제 및 해설-1
23년 3월 모의고사 문제 및 해설-1
어제 3월 모의고사 학생들이 봤습니다. 제 아이들은 아직 어려서.... 많이 기다려야 하지만... 다들 좋은 성과가 있었으면 합니다. 문제풀이 해볼까요?? 1번 문제는 탄소 동소체에 대한 문제입니다
kblue77.tistory.com
1번부터 7번까지는 윗 글 참고하세요^^
8번부터 시작하겠습니다.
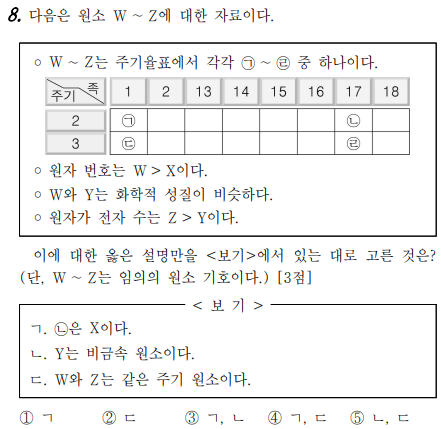
8번 문제는 주기율표를 이해하고 있는지에 대한 문제입니다.
원소가 W ~ Z 까지 4개의 원소가 있네요. 보기 중 'W와 Y는 화학적 성질이 비슷하다.'를 통해서 W와 Y는 같은 족이라는 것을 알 수 있습니다. 따라서, W와 Y는 ㄱ, ㄷ 또는 ㄴ, ㄹ 이죠. '원자 번호는 W > X이다.'를 가지고 유추를 해야 하는데요, ㄱ ~ ㄹ 중 원자번호가 가장 작은 것은 ㄱ 이므로, W는 절대로 ㄱ이 될 수 없네요. 그럼, W가 ㄷ 이라며 ㄱ는 Y가 되네요. ㄴ 는 X가 되므로, ㄹ 는 Z가 되네요. 만약, W가 ㄴ이라면 보기를 만족할 수 없네요^^
ㄱ=Y, ㄴ=X, ㄷ=W, ㄹ=Z 입니다. 답은 알아서 찾아보세요^^
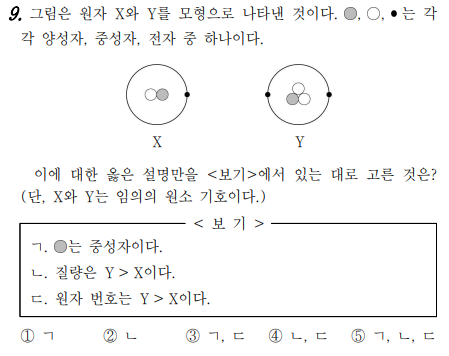
9번 문제는 원자의 구성에 대한 문제입니다. 원자 X와 Y가 모형으로 표시되었는데, 그림에서 양성자, 중성자, 전자를 찾아야 하죠. X에서 검은색 점이 전자라는 것은 알 수 있죠. Y에서 검은색 점이 전자이므로, 흰색 원이 양성자라는 것을 알 수 있습니다. 왜? 원자의 전기적인 성질은 중성이죠. 그럼, 양성자의 수와 전자의 수가 같아야 하므로~~ 색칠한 원이 중성자이네요. 질량은 양성자의 수와 중성장의 수를 더하면 되고, 원자 번호는 양성자의 수입니다.
답은 찾아보세요^&^

10번 문제는 화학결합에 대한 문제입니다. 그림에서 XY는 이온끼리 결합이므로 이온결합이고요, YZY는 전자를 공유하고 있으므로 공유결합이죠.
X와 Y는 몇가의 이온일까요? YZY에서 Y와 Z가 서로 전자를 2개를 공유하고 있죠? 그럼, Y의 원자가 전자수는 6개이므로, 전자 2개를 받으면 옥텟규칙이 성립되므로, Y는 2가 음이온이네요. 그럼 X와 Y는 1대 1로 결합을 하므로, X와 Y의 전하량은 같고, 부호만 반대가 되겠네요. 따라서, m는 2이죠. 그럼, X는 마그네슘이고, Y는 산소이네요. Z는 탄소라는 것을 알 수 있습니다. 마그네슘의 원자가 전자수는 2개이고, 탄소의 원자가 전자수는 4개입니다.
그럼, 답 보이시죠??
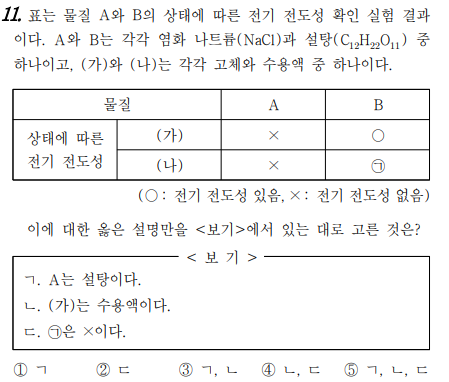
11번 문제는 물질의 전기적 성질에 대한 문제입니다. 설탕과 염화 나트륨이 고체일 때와 수용액 일 때 전기적 성질이 어떻게 되는지 물어보고 있네요. 설탕은 고체이나 수용액에서 전기는 통하지 않죠. 염화나트륨은 고체일 때는 전기가 안 통하지만, 물에 녹은 수용액에서는 이온화가 되므로 전기가 통합니다. 이처럼, 고체일 때는 안 통하고, 수용액상태에서 전기가 통하는 물질을 전해질이라고 하죠. A가 설탕이고, B가 염화나트륨이네요.
답은 찾아보세요^^

12번 문제는 화학 반응식에 대한 문제입니다.
가)는 광합성 화학 반응식이고, 나)는 메테인 연소 화학반응식이네요.
광합성이 일어날 떄 필요한 물질은 이산화탄소와 물이고, 산화환원 반응입니다. 나)에서 화학반응식은 CH4 + 2O2 -> CO2 + 2H2O 이죠. 메테인이 이산화탄소로 변화가 일어나는데, 탄소가 산소와 결합을 하므로 산화반응입니다. 그럼, 누가 환원이 되었을까요? 바로 산소분자는 물이 되면서 산소의 양이 줄어들어죠? 그래서 환원입니다.
산화환원 반응에서 산소와 결합하면 산화이고, 산소를 잃으면 환원입니다. 답은 찾아보세요??
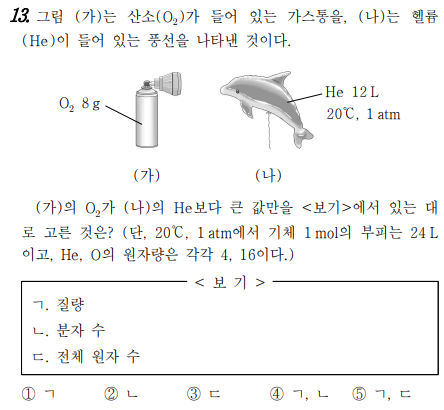
13번 문제는 화학식량과 몰에 대한 문제입니다. 가와 나는 기체가 들어 있는데요, 가에는 산소분자 8g이 들어있고, 나에는 헬륨 분자 12L가 들어 있네요. 그럼, 질량, 분자수, 전체 원자수는 어떻게 알 수 있을까요? 가와 나에 들어 있는 질량이나 부피를 몰수로 바꾸면 됩니다. 우선, 1 mol의 부피가 24L라고 했죠. 그럼, 나에 있는 기체의 양이 12L 이므로, 0.5 mol 이죠. 그리고 가에 질량이 8g이라고 했죠? 산소의 원자량이 16이고, 산소분자의 분자량은 산소원자 2개 이므로, 16+16 =32가 됩니다. 그럼, 1몰일 때 질량 32g이라는 것입니다. 근데, 8g 만 있으므로 1/4 mol이네요.
그럼, 가에는 1/4mol. 나에는 1/2 mol이라는 것 알 수 있습니다.
1몰의 질량은 화학식량에 g을 붙이면 되므로, 산소분자 1 mol의 질량은 32g이고, 헬륨 원자의 1 mol은 4g 이 됩니다. 참고로 헬륨은 원자로 존재하는 단원자 분자입니다.
질량은 가는 8g, 나는 0.5mol 이므로 2g이고, 분자수는 가는 0.25 mol, 나는 0.5 mol, 전체 원자수는 가는 0.25 mol O2 이므로 산소원자수는 0.5 mol, 나는 0.5 mol He 이므로 헬륨원자수는 0.5 mol입니다.
13번까지 해설을 했습니다.
나머지는 조금 있다가 포스팅 할께요^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^
