3월 모의고사 (2학년) - 마지막
내일이 3월 모의고사이네요^^
다들 홧팅하세요^^
2023.03.21 - [고등화학1] - 3월 모의고사 대비 (2학년) -1
3월 모의고사 대비 (2학년) -1
목요일에 3월 모의고사이네요~~ 그래서 준비했습니다.^^ 3월 모의고사 대비~~~ 2학년 모의고사와 1학년 모의고사 둘 다 해설을 하도록 할게요^^ 좋은 성적이 나올 수 있도록 파이팅입니다. 1번 문제
kblue77.tistory.com
2023.03.21 - [고등화학1] - 3월 모의고사 대비 (2학년) -2
3월 모의고사 대비 (2학년) -2
2023.03.21 - [고등화학1] - 3월 모의고사 대비 (2학년) -1 3월 모의고사 대비 (2학년) -1 목요일에 3월 모의고사이네요~~ 그래서 준비했습니다.^^ 3월 모의고사 대비~~~ 2학년 모의고사와 1학년 모의고사
kblue77.tistory.com
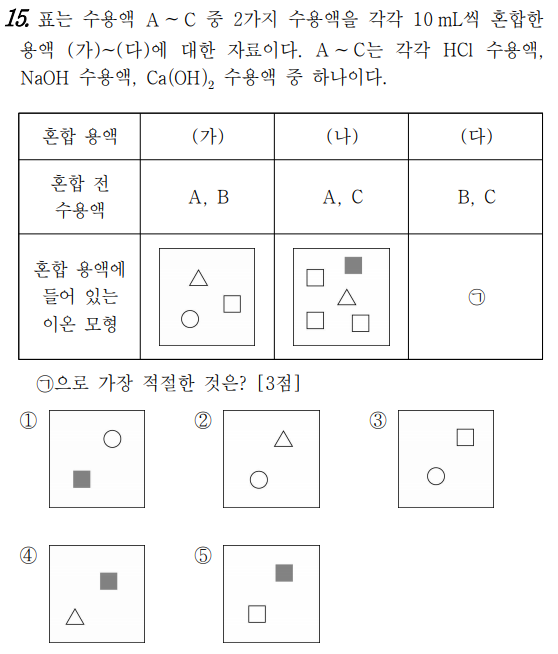
15번 문제는 중화반응에 대한 문제입니다.
가~다 까지 어떤 용액끼리 혼합한 것을 알면 정말로 쉬운 문제가 되는데, 그런 부분이 없네요. 그럼, 두 용액 중 하나만 중화반응이 안 일어나는 반응이네요. 염기끼리 혼합한 것이죠. 염기가 하나는 NaOH이고, 또 하나는 Ca(OH)2인데, 수산화칼슘에서 칼슘이온과 수산화이온의 반응비는 1대 2이죠. 만약 A가 염산이고, B 수산화나트륨, C가 수산화칼슘이라고 한다면 가) 용액에 같은 부피의 염산과 수산화나트륨이 들어가므로, 남아있는 이온은 두 개만 있어야 하는데, 세 개로 표시하였죠. 따라서 A는 염산이 아니라는 것이네요. 그럼 (가)는 수산화칼슘과 염산이나 수산화나트륨이 되어야 하는데, 만약 가)에 혼합한 용액이 수산화나트륨과 수산화칼슘이라고 하면 이온은 칼슘이온, 나트륨이온, 수산화이온이 있어야 하고, 비율은 1대 1대 3 이어야 하네요. 따라서 가)는 수산화칼슘과 염산이어야 합니다. 그리고 나)는 수산화나트륨용액과 수산화칼슘용액이네요. 그림에서 세모는 칼슘이온, 네모는 수산화이온, 동그라미는 염화이온, 색칠한 네모는 나트륨이온이네요.
다)에는 수산화나트륨 용액과 염산 용액이 혼합하면, 수소이온과 수산화이온은 물을 생성하고, 나머지 염화이온과 나트륨이온만 존재하게 됩니다.

16번 문제는 물질의 성질에 대한 내용이네요.
A와 B는 염화칼륨과 설탕이네요. 고체와 수용액에서 전기전도성을 측정하면 고체와 수용액에서 전기전도성이 없으면 부도체이고, 고체에서는 없지만, 수용액에서 전기전도성이 있으면 전해질이네요. 설탕과 염화칼륨은 고체에서는 전기전도성이 없지만, 염화칼륨은 물에 녹인 수용액에서는 이온화가 되므로 전기전도성이 있죠. 따라서 B가 염화칼륨이고, A는 설탕입니다. 그럼 정답은 직접 찾아보세요^^

17번 문제는 금속의 반응성에 대한 문제입니다.
금속은 반응성이 클수록 전자를 다른 물질에게 줄려고 하는 특징을 가지고 있는데, 금속끼리도 반응성이 다르죠. 그럼 이 문제에서 금속 A와 금속 B의 반응성을 어떻게 확인할 수 있을까? 문제에 보시면 금속 A를 BNO3 수용액에 넣었는데, 금속 B가 석출 되고, A2+가 생성되었다고 하네요. 그러면 금속 A와 금속 B의 반응성은 A가 크다고 할 수 있죠. 왜? 전자를 B에게 주었기 때문에~~(반응성이 클수록 전자를 다른 물질에게 줄려고 합니다.)
금속 A를 BNO3 수용액에 넣어주면 금속 A는 자신이 가지고 있는 전자를 B+에게 주고, A는 A2+가 되고 B+는 전자를 받아서 금속 B가 되네요. 금속 A 하나는 전자 두 개를 주므로 금속 B는 2개가 석출이 됩니다. 따라서 수용액에 있는 2개의 B+가 전자 2개씩 받아서 2개의 금속 B로 석출이 되고, 금속 A는 A2+ 이온으로 되죠. 그러면 수용액에 있는 양이온의 수는 점점 줄어들겠네요.
질량은 원자량을 가지고 계산하면 되는데요, 감소한 A의 질량이 1개라면 석출 된 B는 2개 되죠. 그러면 A의 원자량은 207, B의 원자량은 108인데, 2개가 석출 되므로 B의 질량은 108X2 이렇게 계산하면 됩니다.

18번 문제도 중화반응에 관한 문제입니다.
NaOH 수용액과 HCl 수용액의 부피를 달리하여 혼합을 하면 산과 염기가 반응하여 중화반응이 일어나겠죠? NaOH에는 나트륨이온과 수산화이온이 1대 1이고, HCl에도 수소이온과 염화이온이 1대 1이죠. 그럼 부피만 다르게 하여 혼합하였다고 하니 자료를 보면서 설명할게요.
가)에는 NaOH가 10ml, HCl는 5ml 이므로 염산의 부피가 작기 때문에 수산화이온이 남겠네요.
나와 다)에는 NaOH가 10ml, HCl는 15ml, 30ml이므로 염산의 수소이온이 남겠네요. 왜? 중화반응에서 수소이온과 수산화이온이 1대 1로 반응해야 하기 때문입니다.
가)에 들어 있는 이온은 나트륨 이온, 염화이온, 수산화이온이 있는데, 양은 나트륨이온이 가장 많고, 염화이온과 수산화이온은 같네요. 나)에는 나트륨이온, 염화이온, 수소이온이 있는데, 양은 염화이온이 가장 많고, 나트륨이온이 두 번째, 수소이온이 세번째이네요. 다)도 나)와 비슷하겠지만, 염화이온이 가장 많고, 수소이온이 두번째, 나트륨이온은 세 번째가 되겠네요. 이해가 되시나요???
NaOH 10ml 라고 했죠. NaOH를 이온화하면 나트륨이온(Na+첨자가 안 되는 관계로 한글로 적을게요^&^)과 수산화이온이 각각 10ml가 반응했다고 보시면 됩니다. 그럼, HCl 5ml는 수소이온과 염화이온이 각각 5ml씩 있다고 보면 되죠.
가)에서 수소이온과 수산화이온이 반응하여 물을 생성하는데 1대 1로 반응해야 하죠. 그런데 수소이온이 5ml밖에 없어요. 그럼 수산화이온도 5ml만 반응하고, 5ml는 남게 되는 것이죠. 이해가 되시나요??
나)에서 ㄱ/ㄴ이 1/2이라고 했죠. 나에는 나트륨이온 10ml, 염화이온이 15ml, 수소이온이 5ml 있으니까 ㄱ는 수소이온이 되고, ㄴ은 나트륨이온이 되는 것이에요^^
그럼 다)는 나트륨이온은 10ml, 염화이온이 30ml, 수소이온이 20ml 있으므로 ㄱ/ㄴ는 20/10=2가 되어야 합니다.
생성된 물분자수는 수소이온과 수산화이온이 만나는 부피로 계산하면 되는데, 가)는 수소이온 5ml와 수산화이온 5ml가 반응하므로 물은 5ml, 나)는 수소이온이 10ml, 수산화이온도 10ml 반응하므로 물은 10ml가 생성되네요. 그럼 나)가 가)에 2배라는 것을 알 수 있습니다.
글로 작성을 하려고 하니 힘드네요 ㅠㅠㅠ

19번 문제는 분자에 대한 문제입니다.
분자 AB3과 A2B2가 있네요. 원자량은 B가 A보다 크다고 나왔습니다.
ㄱ. 분자량은 AB3> A2B2이다. - 원자 A의 원자량을 a, 원자 B의 원자량은 b라고 하면 AB3의 분자량은 a+3b이고 A2B2의 분자량은 2a+2b가 되네요. a+3b - (2a+2b)을 해서 0보다 크면 a+3b가 크다고 할 수 있죠??
ㄴ. AB3에서 B의 질량/A의 질량 > 3이다. - AB3에 원자수의 비는 A:B =1:3이네요. A의 질량은 a, B의 질량은 3b이죠. 3b/a이므로 3보다 크네요.
ㄷ. AB3과 A2B2의 구성원자수는 같죠. 그럼, 1g을 1몰이라고 할께요. 그럼, 1몰에 들어있는 A원자수를 비교를 해도 상관은 없어요. 왜? 어차피 1몰에 있는 원자수를 1g에 맞춰서 나누시면 되기 때문이죠? 이해가 안되시면 이렇게 생각하시면 되요. 물 분자와 이산화탄소 분자가 있는데, 구성원자수는 같죠. H2O, CO2 이니까요~ 각각1몰이 있다고 가정하면 물분자에 있는 산소원자수는 1몰이 되고, 이산화탄소 1몰에 있는 산소원자수는 2몰이 되네요. 1몰은 6.02 X 10^23개 이니까, 아보가드로수로 나눠도 물분자와 이산화탄소분자에 산소원자수는 1몰/6.02X10^23, 2몰/6.02X10^23 이렇게 되므로 같아요^^
따라서, A2B2 1g에 있는 A원자수는 AB3 1g에 있는 A원자수의 2배이라는 것입니다.
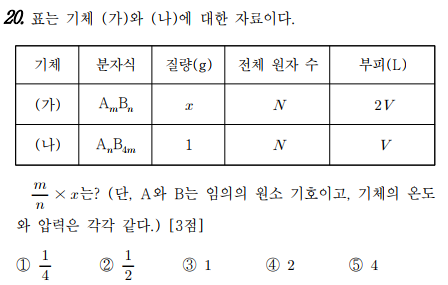
20번 문제는 기체의 양적관계 문제입니다.
같은 온도와 압력일 때 부피비는 몰수비와 같아요. 따라서 가)와 나)의 부비피가 2 : 1 이므로 몰수비도 2 : 1이 됩니다. 그럼, 가) 분자의 몰수는 2(m+n)이고, 나) 분자의 몰수는 (n+4m)이 돼요. 2(m+n) : (n+4m) = 2 :1 계산하면 n=2m이 됩니다.
가의 분자식은 AmB2m이고, 나의 분자식은 A2mB4m이 되네요. 분자량비를 계산할 수 있죠. 가의 분자량은 3m이고, 나의 분자량은 6m이므로 분자량비가 1 : 2이네요. 현재 나의 질량이 1이고, V(1몰이라고 할게요^^)이고, 가의 질량은 x이고, 2몰인데, 전체원자수는 같다. 가의 분자량이 나의 분자량보다 2배 작은데, 몰수가 2배 더 많아야 하므로, 가의 질량은 나의 질량과 같아야 하네요. 그럼 x는 1이므로, m/n X x = m/2m X 1 = 1/2가 되네요.
2023.03.21 - [고등화학1] - 3월 모의고사 대비 (2학년)- 3
3월 모의고사 대비 (2학년)- 3
1번부터 11번 까지 달려왔습니다. 2023.03.21 - [고등화학1] - 3월 모의고사 대비 (2학년) -1 3월 모의고사 대비 (2학년) -1목요일에 3월 모의고사이네요~~ 그래서 준비했습니다.^^ 3월 모의고사 대비~~~ 2학
kblue77.tistory.com
이상 3월 모의고사 해설이었습니다.^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^
