과외하는 두 아이의 아빠
1단원 - 화학식(분자식), 이온 본문
1단원 마지막입니다.
단원별 순서는 분자를 정리하면서 분자식, 그리고 이온과 이온을 확인하는 방법으로 나와 있는데, 저는 조금 다르게 이온과 분자, 그리고 이온 확인방법으로 정리를 하도록 하겠습니다.
- 화학식 -
화학식이란 물질을 구성하는 원소들을 기호나 그림으로 표시하는 것을 말합니다. 모든 물질을 표현하는 식이라고 보시면 됩니다. 왜 화학식을 사용할까요? 화학식은 공통입니다. 우리나라 사람들은 한국어를 사용하죠. 다른 나라에서는 한국어가 아닌 영어, 프랑스어, 일본어, 독일어등 정말로 다양한 언어를 사용합니다. 그런데, 한 물질을 표현하는 데 여러 나라의 언어를 사용한다면 어떻게 될까요? 소통이 될까요? 안 되겠죠? 그래서 공통의 언어인 화학식을 사용합니다.
화학식에는 4가지가 있습니다. 실험식, 분자식, 시성식, 구조식이죠. 중학교에서는 분자식만 배웁니다. 나머지는 고등학교 화학시간에 배워요. 분자에서 설명을 했지만, 모든 물질을 분자식으로 표현은 못한다고 했죠? 왜? 금속같은 경우 금속원자들이 쭉 연결이 되어 있어요. 그래서 어디부터 어디까지를 한 단위로 끝을 수가 없기 때문입니다. 이런 경우는 이온들의 비율을 가지고 화학식을 만들기도 합니다. 여기서는 분자식만 다루도록 할게요^^
- 분자식 -
분자식이란 물질을 구성하는 원소들을 기호와 숫자로 표현한 화학식의 일종입니다. 분자식을 알면 분자를 구성하는 원자와 원자의 개수를 확인할 수 있습니다. 예를 들면 물 분자의 분자식은 H2O(첨자가 안되어요 ㅠㅠㅠ)입니다.

그림에서 물분자는 수소와 산소로 이루어져 있죠. 산소 원자 1개와 수소 원자 2개로 구성되어 있다는 것을 알 수 있습니다. 수소 원자의 개수가 2이죠. 그럼, 수소 기호 뒤에 작게 2라고 쓰고 산소 원자는 1개인데, 1은 생략합니다.
그럼, 물분자가 2개이면 어떻게 표현할까요?
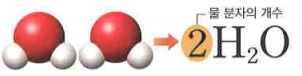
물분자가 2개이면 그림처럼 표현합니다. 가끔 학생들이 H4O2 또는 H2O2 등등 정말로 다양한 표현을 하는데, 물 분자의 분자식은 H2O입니다. 절대로 저 분자식을 마음대로 바꾸시면 안 됩니다. 왜? 약속이면서 규칙이니까요, 여러분의 친구가 자신의 이름을 다르게 말하면 기분이 안 좋잖아요? 분자도 그렇지 않을까? 생각합니다. ㅋㅋㅋ
- 이온 -
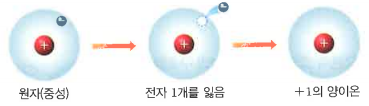
- 이온이란 전하를 띤 입자를 말한다. 원자는 전기적으로 중성이지만, 원자핵을 중심으로 돌고 있는 전자 중 일부가 다른 원자로 이동이 가능합니다.
- 양이온은 원자가 전자를 잃어버려서 (+) 전하를 띤 입자를 말합니다. 그럼, 원자핵의 총전하량은 변함이 없지만, 전자의 총전하량이 감소하겠죠? 전자를 잃어버렸으니까요~ 원자핵의 (+) 총 전하량과 전자의 (-) 총전하량을 비교하면
| 원자핵의 (+) 총 전하량 > 전자의 (-) 총 전하량 |
그리고 전자를 잃어버린 개수가 1개이면 +1 양이온, 2개이면 +2 양이온이라고 하죠.
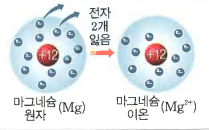
| 모형 | 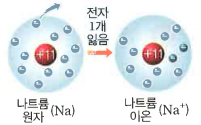 |
 |
||
| 원자 | 이온 | 원자 | 이온 | |
| 원자핵의 전하 | +11 | +11 | +12 | +12 |
| 전자수 | 11 | 10 | 12 | 10 |
| 전자의 전하 | -11 | -10 | -12 | -10 |
| 전하량의 합 | 0 | +1 | 0 | +2 |
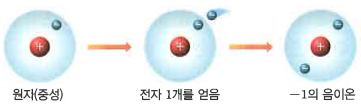
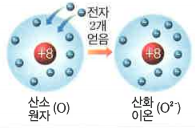
- 음이온은 원자가 전자를 얻어서 (-) 전하를 띤 입자를 말합니다. 양이온과 마찬가지로 원자핵의 총전하량은 변함이 없고, 전자의 개수만 늘어났기 때문에 전자의 (-) 총 전하량은 증가하겠죠? 원자핵의 (+) 총 전하량과 전자의 (-) 총전하량을 비교하면 다음과 같아요.
| 원자핵의 (+) 총 전하량 < 전자의 (-) 총 전하량 |
전자를 얻는 개수에 따라서 전하량도 달라지는데요, 1개를 얻으면 -1 음이온, 2개를 얻으면 -2 음이온이라고 합니다.
| 모형 |  |
 |
||
| 원자 | 이온 | 원자 | 이온 | |
| 원자핵의 전하 | +9 | +9 | +8 | +8 |
| 전자수 | 9 | 10 | 8 | 10 |
| 전자의 전하 | -9 | -10 | -8 | -10 |
| 전하량의 합 | 0 | -1 | 0 | -2 |
- 주의사항 -
이온이 될 때 변하는 것은 전자의 개수만 변할 뿐 양성자의 개수는 절대로 변하지 않는다. (중학교 과정에 한해서)
고등학교 화학에서는 이온이 되면 이온의 크기가 변한다는 것도 배우게 됩니다. 하지만, 그것은 고등학교 때 배우세요^^
- 이온의 표시 -
- 이온식 : 이온을 알아봤는데, 그럼 이온을 어떻게 표시할까요? 이온도 원소기호를 가지고 표시를 합니다. 이온이 띠는 전하의 크기 및 종류를 표시한 식을 이온식이라고 합니다.
- 양이온: 원소 기호를 중심으로 오른쪽 위에 +를 적으면 양이온이고, +앞에 잃어버린 전자수를 적으면 됩니다.

읽을 때는 원소 이름 뒤에 ~이온을 붙이시면 됩니다. 예를 들면 나트륨이 양이온이 되었다면 '나트륨이온' 이렇게 하면 돼요.
- 음이온: 원소 기호를 중심으로 오른쪽 위에 -를 적으면 음이온이고, -앞에 얻은 전자수를 적으면 됩니다.

읽을 때는 원소 이름 뒤에 ~화이온을 붙이시면 되는데, 원소 이름이 '~소'로 끝나는 경우 소를 빼고 '~화이온'이라고 읽으면 되는데요, 예를 들면 산소가 음이온이 되면 산소화이온(X)이 아니라 산화이온(O)이 됩니다. 황이 음이온이 되면 황화이온이라고 읽으면 됩니다.
- 여러 가지 이온들 -
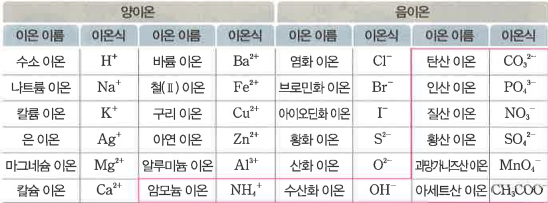
표에서 색이 이온은 다원자 이온이라고 하는데요, 보통 이온이 한 개의 원자로 이루어져 있다면, 다원자 이온은 여러 개의 원자로 이루어진 이온을 말합니다. 이온도 원자나 분자식처럼 마음대로 바꾸면 안 됩니다.
- 이온들로 이루어진 화합물 -
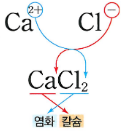
이온들로 이루어진 화합물을 이온화합물이라고 합니다. 이온화합물은 양이온과 음이온이 결합하여 서로 전기적 성질이 반대이므로 잡아당기는 인력이 작용하여 결합한 물질을 말하는데요, 분자식이 아닌 화학식으로 표현합니다. 이유는 양이온과 음이온 규칙적인 결정으로 이루어져 있는데요, 이런 경우는 분자식으로 표현할 수 없습니다. 왜? 이온들이 끊임없이 이어지기 때문이죠. 그래서 이런 경우는 이온들의 개수비를 비율로 하여 화학식을 표현합니다.
1) 양이온과 음이온 중 순서는 양이온 원소기호를 먼저 쓰고, 뒤에 음이온 원소기호를 적습니다.
2) 양이온 와 음이온의 개수비를 표시하면 되는데요, 표시할 때는 반드시 원소 기호 뒤에 숫자를 작게 적어서 표시합니다.

화학식에서도 1은 생략합니다.
좀 더 쉽게 작성하는 방법은 아래 그림처럼 전하량을 가지고 작성하면 조금 편리하죠^^
이상 분자, 이온에 대한 포스팅이었습니다. 다음에는 이온을 확인하는 방법에 대해서 포스팅할꼐요^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^

'중등과학문제 > 중2 과학이론' 카테고리의 다른 글
| 2단원 마찰전기와 정전기 유도 (16) | 2023.03.30 |
|---|---|
| 1단원 - 이온 확인 방법 (18) | 2023.03.28 |
| 1단원 - 원소 기호 (14) | 2023.03.27 |
| 1단원 - 원자와 분자(2) (29) | 2023.03.26 |
| 1단원- 원자와 분자 (1) (18) | 2023.03.26 |




