과외하는 두 아이의 아빠
중3 1단원 질량 보존 법칙, 일정성분비 법칙, 기체 반응 법칙 본문
1단원 화학에서 나오는 3가지 법칙
바로 질량 보존 법칙, 일정성분비 법칙, 기체 반응 법칙입니다.
- 질량 보존 법칙 -
질량 보존 법칙은 문자 그대로 해석하면 돼요. '반응 전과 후 질량은 변하지 않는다.' 뜻입니다. 왜 변하지 않을까요? 이유는 화학반응이 일어날 때 원자가 다른 원자로 바뀌거나 , 새로운 원자가 생성되거나, 전에 있던 원자가 소멸 되지 않기 때문이죠. 즉, 반응 전과 후 원자는 변하지 않고, 반응 전에 들어있던 원자의 개수도 변하지 않으므로 질량은 변하지 않습니다. 추가로 질량은 입자의 개수로 보셔도 됩니다. 예를 들어, 검은색 구슬 10개가 있는 유리관에 하얀색 구슬 10개를 넣어도 넣기 전 총구슬의 개수와 넣은 후 총구슬의 개수는 변하지 않죠. 여기서 구슬은 원자로 보고, 입자수는 원자수로 보시면 돼요. 이해가 되시나요?
근데, 이 반응은 물리변화이죠. 그럼 화학변화에서는 어떻게 될까요? 물분자를 만드는 화학반응식을 보면서 설명할게요

산소원자 1개와 수소원자 2개가 만나서 물분자 한 개를 만들죠. 그림 보시면, 빨간색이 산소, 흰색이 수소이예요. 물분자가 되기 전과 후를 비교하면, 원자가 바뀌거나, 생성되거나, 소멸된 것 없고, 총원자수도 변하지 않죠. 이처럼 화학변화(반응)가 일어나도 질량은 변하지 않는다. 이것이 질량 보존의 법칙이에요. 질량 보존의 법칙은 물리변화든 화학변화든 무조건 성립합니다. 참고로 질량 보존의 법칙은 라부아지에라는 화학자가 발표했어요. 이해가 되시나요?
- 일정 성분비 법칙 -
일정성분비 법칙은 프랑스 과학자 프루스트가 인공적으로 만든 탄산구리와 천연 탄산구리의 조성이 같다고 하면서 발견했는데, 한 화합물을 구성하는 원자들 간의 질량비는 항상 같다는 것입니다.
예를 들면, 물을 전기분해하면 수소와 산소의 질량비는 1대 8입니다. 한분자의 물을 만들거나, 100개의 물분자를 만들거나 물을 만들 때 수소와 질량비는 항상 1대 8이라는 것이죠.

수소의 질량 1g, 산소의 질량 16g이므로, 수소 2개와 산소 1개가 만나서 물 1개를 만들 때 질량비 계산이 되시죠?
그럼 첫 번째 그림과 두 번째 그림 뭐가 다른 것 보이나요? 첫 번째 그림처럼 화학반응식을 사용하면 안돼요. 왜냐하면 화학반응식을 만들 때 수소나 산소는 원자로 존재하지 않고 분자로 존재하기 때문에 아래 그림처럼 해야 정확한 반응식이 됩니다.
- 기체 반응 법칙 -
게이뤼삭이 발표한 기체반응 법칙은 같은 온도, 같은 압력하에 반응하는 기체와 생성되는 기체사이에서는 간단한 정수비가 성립된다는 법칙입니다.
수소와 산소가 반응하여 물을 생성할 때 수소와 산소의 부피비는 2대 1이고, 생성되는 물분자의 부피는 2가 된다.

근데 같은 온도, 같은 압력하에 들어가는 부피에는 같은 수의 입자가 들어가야 하므로 산소원자가 생성물이 되면 쪼개지고, 돌턴의 원자설에 위배가 되므로 아보가드로는 분자라는 개념을 도입하면서 기체반응의 법칙을 설명하였다. 분자는 물질의 성질을 지닌 가장 작은 입자로, 아보가드로는 같은 온도, 같은 압력일 때 같은 부피 속에는 같은 수의 입자가 들어 있다는 아보가드로의 법칙을 발표합니다. (참고로 개수는 6.02 X 10의 23승으로, 고등학교 화학시간에 배워요^^)
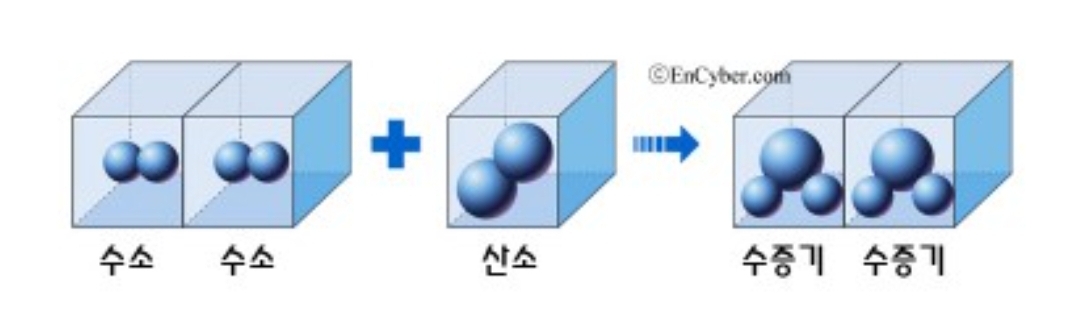
3가지 법칙 이해가 되나요? 물리변화는 질량보존의 법칙만 성립하고, 화학변화는 모든 법칙 성립한다.
폰으로만 작성하려니 매우 힘드네요.
이해가 안 되면 댓글 주세요^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^

'중등과학문제 > 중3 과학이론' 카테고리의 다른 글
| 역학적 에너지 보존 법칙 (30) | 2023.01.18 |
|---|---|
| 중3 에너지와 일의 전환 (10) | 2023.01.05 |
| 중3 에너지(위치에너지, 운동에너지) (7) | 2023.01.04 |
| 중3 과학에서 일 (2)- 중력에 대한 일 (16) | 2023.01.03 |
| 중3 과학에서 일이란??? (18) | 2023.01.03 |





