며칠 전 대통령의 수능발언으로 인하여 학생과 학부모님들 많이 황당하게 만들었는데... 대통령의 말 한마디가 엄청난 파장을 일으키고 있다는 것.... 그냥 어이가 없네요~~
그래도 시험은 다가옵니다. 우리는 우리의 일을 먼저 합시다~~
화학1 2단원 원자의 세계 기출문제 5번째 시간입니다.
문제풀이를 적기 때문에 따로 답은 안 적습니다. 풀이를 꼼꼼하게 읽으면 답이 보여요~~
원소의 특성 및 원자의 전자배치

문제풀이
3주기 원소 A ~ C 가 있네요. 참고로 모두 바닥상태~~ 자료를 보면
1) 원자 반지름은 C가 가장 작다. - 원자 반지름은 같은 주기에서는 원자번호가 증가할수록 작아집니다. 왜? 같은 주기이면 전자껍질의 수는 같죠. 그런데 원자번호가 증가할수록 양성자수도 증가하죠. 그러면 유효핵전하가 점점 커지게 됩니다. 따라서 3주기에서 원자 반지름이 가장 작은 것은 17족 원소가 됩니다.(18족 제외)
따라서 A ~ C 중 C의 원자번호가 가장 크네요.
2) 이온화 에너지는 A가 가장 크다. - 이온화 에너지는 가장 바깥쪽에 전자를 하나를 떼어낼 때 필요한 에너지이죠. 1족에 해당하는 원자들의 이온화 에너지가 가장 작죠. 왜? 1족에는 가장 바깥쪽에 전자가 1개이죠. 그리고 원자핵으로부터 거리가 멀리 떨어져 있어서 전자를 떼어낼 때 에너지를 작죠. 그런데 원자번호가 증가하면 양성자수가 증가하여 유효핵전하도 증가하죠. 그러면 전자를 떼어내는데 더 많은 에너지가 필요합니다. 일반적으로 원자번호가 증가할수록 이온화 에너지는 증가하는데, 예외가 있습니다. 2족과 13족, 15족과 16족인데요~ 2족과 13족은 베릴륨과 붕소, 마그네슘과 알루미늄이 해당되죠? 원자번호는 13족이 크기 때문에 이온화 에너지도 커야 합니다. 하지만, 이온화 에너지를 계산하면 2족이 크죠. 왜? 2족의 전자배치는 2s2 또는 3s2로 끝나고, 13족은 2p1 또는 3p1으로 끝나죠. s오비탈과 p오비탈 중 에너지는 s오비탈이 크죠. 그래서 이온화 에너지는 2족이 13족보다 크죠. 15족과 16족의 전자배치는 p오비탈로 끝나는데요, 15족은 2p3 또는 3p3이고 16족은 2p4 또는 3p4로 16족에는 전자쌍이 한 개 있죠. 그럼 전자를 떼어낼 때 전자쌍이 홀전자를 밀어주는 효과를 가져다주기 때문에 16족이 15족보다 이온화에너지가 커야 하는데, 그렇지 않은 이유입니다.
문제로 돌아와서 원자 반지름은 C가 가작 작으므로 원자번호는 C가 가장 커야 하므로, A는 C앞에 있는 있어야 하네요. 따라서 C와 A는 2족과 13족 또는 15족과 16족이 되어야 합니다.
3) 홀전자 수 A와 B의 합이 C와 같다. - 만약 C와 A가 16족과 15족 이라면 A의 홀전자수는 3이므로 자료는 거짓이 되죠. 따라서 A와 C는 2족과 13족이고, 원자번호는 C> A가 되네요. C는 알루미늄이고, 홀전자수는 1개, A는 마그네슘이고 홀전자수는 0, 따라서 B는 나트륨밖에 될 수 없네요. 홀전자수가 1인 3주기에는 나트륨, 염소, 알루미늄이 있는데, 원자 반지름은 C가 가장 작다고 했기 때문에 B는 나트륨이 됩니다.
그럼 원자번호순으로 나열 가능하시죠??
원자의 구성입자
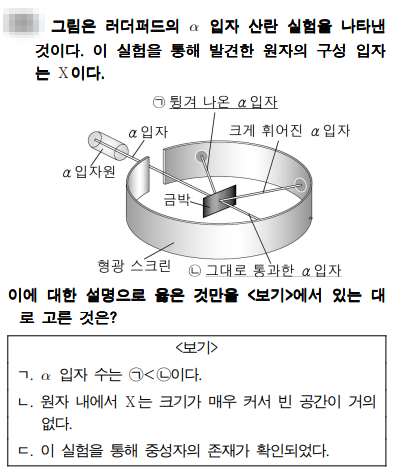
문제풀이
문제에서 실험은 러더퍼드의 알파입자 산란실험이네요. 러더퍼드는 이 실험을 통해서 원자 내부는 거의 비어 있다는 것을 알게 되었고, 또 원자 중심에는 원자핵이 있다는 것을 알게 되었죠.
ㄱ. 알파 입자수는 ㄱ<ㄴ이다. - 원자 내부는 거의 빈 공간이므로 알파입자는 거의 통과를 하고, 일부만 튕겨나가게 되죠. 따라서 튕겨나간 수(ㄱ) 보다 통과하는 입자수(ㄴ)가 더 많죠.
ㄴ. 원자 내에서 X는 크기가 매우 커서 빈 공간이 거의 없다. - X는 원자핵으로 양성자로 이죠. 원자핵은 원자 내에서 차지하는 부피는 매우 작죠. 크기도 작다는 것을 실험을 통해서 확인을 합니다.
ㄷ. 이 실험을 통해서 중성자의 존재가 확인되었다. - 이 실험을 통해서 확인된 것은 원자핵이고, 알파입자가 산란이 된 것은 같은 종류의 전하로 이루어져 있기 때문이라고 하죠. 따라서 원자핵에는 양성자가 들어 있다는 것을 알게 되었죠. 중성자는 채드윅 통해서 알게 되었습니다.
이온반지름
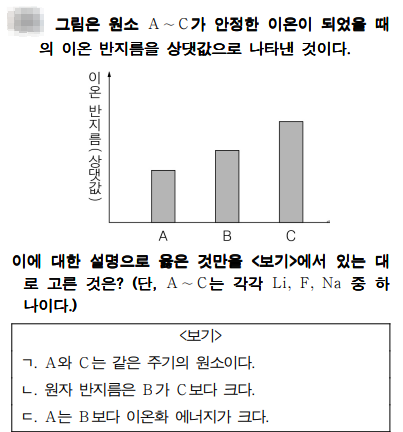
문제풀이
A ~ C까지 이온반지름의 상대적인 값이네요. A ~ C의 원소는 Li, F, Na 이므로 세 원소중 이온 반지름이 가장 작은 것은 Li이고, Na, F 순입니다. 따라서 A = Li, B=Na, C=F이네요.
ㄱ. A와 C는 같은 주기의 원소이다. - Li와 F는 2주기 원소이죠.
ㄴ. 원자 반지름은 B가 C보다 크다. - B는 Na, C는 F 이죠. Na는 3주기, F는 2주기 이므로 Na의 원자 반지름이 크죠.
ㄷ. A는 B보다 이온화 에너지가 크다 - 이온화 에너지는 같은 족일 때 원자 번호가 작을수록 크죠. 따라서 A는 Li, B는 Na이므로 Li의 이온화 에너지가 큽니다.
오비탈
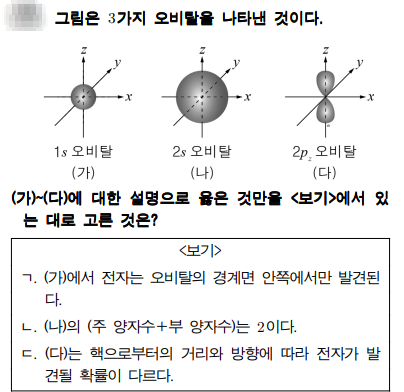
문제풀이
가는 1s 오비탈, 나는 2s 오비탈, 다는 2pz 오비탈이네요.
ㄱ. 가)에서 전자는 오비탈의 경계면 안쪽에서만 발견된다. - s 오비탈에서 전자가 발견될 확률이 가장 높은 곳은 경계면 안쪽이지만, 바깥쪽에서 발견확률이 0은 아닙니다.
ㄴ. 나)의 (주 양자수 + 부 양자수)는 2이다. - 2s 오비탈에서 주 양자수는 2이고, 부(방위) 양자수는 s이죠. 부 양자수는 주 양자수 - 1로 계산을 하고, 0부터 (주 양자수 -1)까지입니다. s 오비탈의 부 양자수는 0이죠. 따라서 주 양자수 + 부 양자수는 2이죠.
ㄷ. 다)는 핵으로부터 거리와 방향에 따라 전자가 발견될 확률이 다르다. - 2p 오비탈에는 x, y, z 축으로 분포합니다. 각각의 오비탈에 따라서 전자가 발견될 확률이 다르죠. 2px에서 전자가 발견될 곳은 x축에서 가장 크고, 다른 y나 z 축에서는 발견될 확률은 0입니다.
유효핵전하와 이온화 에너지
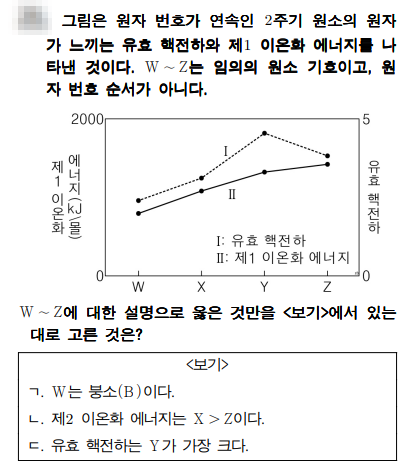
문제풀이
그림은 2주기 원자의 유효핵전하와 제1 이온화 에너지를 나타낸 그래프이네요. 2주기 원소는 연속적이라는 것에 포인트를 맞추세요^^
유효핵전하는 원자번호가 증가할수록 커지죠. 그럼 원자번호는 X< Y 이죠. 그런데, Y와 Z를 보면 유효핵전하는 Y가 큰데, 제1 이온화에너지는 Z가 크네요. Y와 Z는 2족과 13족 또는 15족과 16족의 원소로 보시면 되죠. 만약 2족과 13족이라면 W부터 Z까지 연속적인 2주기 원소가 될 수 없으므로 Y와 Z는 16족과 15족입니다. 따라서 Y는 산소, Z는 질소, X는 14족인 탄소, W는 붕소이네요.
ㄱ. W는 붕소이다. - 위 설명 참조
ㄴ. 제2 이온화 에너지는 X > Z 이다. - 제2 이온화에너지가 가장 큰 족은 2족이죠. X는 14족, Z는 15족이네요. 제 2이온화 에너지도 제1 이온화 에너지처럼 원자번호가 클수록 증가를 하죠.
ㄷ. 유효 핵전하는 Y가 가장 크다. - Y가 산소이므로 원자번호가 가장 크므로 유효 핵전하도 가장 크죠.
이상 화학 1 2단원에 대한 기출문제 풀이였습니다.^^ 기말고사에 많은 도움이 되었으면 합니다.^^
구독과 하트, 광고는 제게 큰 도움이 됩니다.^^

'고등화학1' 카테고리의 다른 글
| 화학1 2단원 원자의 세계 기말고사 기출문제 -7 (11) | 2023.06.20 |
|---|---|
| 화학1 2단원 원자의 세계 기말고사 기출문제 -6 (13) | 2023.06.19 |
| 화학1 2단원 원자의 세계 기말고사 기출문제 풀이-4 (11) | 2023.06.12 |
| 화학1 2단원 원자의 세계 기말고사 기출문제 풀이-3 (5) | 2023.06.12 |
| 화학1 2단원 원자의 세계 기말고사 기출문제 풀이-2 (12) | 2023.06.11 |

