중간고사 기간이 거의 끝나가고 있네요. 다 끝난 학생들도 있을 것이고, 시작하는 학생들도 있겠죠? 다들 최선을 다해서 임했으면 합니다. 이번에는 2학기 중간고사 기출문제 풀이 마지막입니다. 물질의 특성에 대한 문제 위주로 풀이를 하도록 하겠습니다. 많은 학생들에게 도움이 되었으면 합니다. 그럼 시작해 볼까요?

17번 문제
밀도에 대한 문제입니다.

문제풀이
밀도는 질량 / 부피로 계산하는 물질의 특성입니다. 물질의 특성은 한 물질만이 가지는 고유한 성질로, 물질의 특성에는 밀도, 녹는점, 끓는점, 용해도, 겉보기 성질등이 있습니다. 같은 물질이라면 양에 관계없이 물질의 특성은 같다는 것 잊지 마세요.
밀도는 일반적으로 고체 > 액체 > 기체 순입니다. 하지만, 예외가 있죠. 물입니다. 물이 고체가 되면 얼음이죠. 얼음과 물의 밀도를 비교하면 얼음의 밀도가 물의 밀도보다 작아요. 그 이유는 물이 얼음이 될 때 분자들이 모이게 되는데, 이때 빈 공간이 물에 비해서 많이 생기게 됩니다.(수소결합 때문입니다.) 빈 공간이 많아지면 부피가 커지게 되어 물의 밀도가 얼음의 밀도보다 크죠.
18번 문제
밀도를 계산하는 문제입니다.

문제풀이
밀도는 질량 / 부피로 계산을 합니다. 어떤 물질이 물에 넣었는데, 물 위에 뜨거나 가라앉게 되는 경우 물의 밀도와는 어떤 관련이 있을까요? 기준이 되는 밀도보다 작으면 물체는 뜨게 되고, 밀도가 크면 가라앉게 됩니다. 예를 들어 모래와 스타이로폼를 준비해서 물에 넣어주면 모래는 아래쪽에 있고, 스타이로폼은 위에 위치합니다. 이는 모래의 밀도가 물보다 크고, 스타이로폼의 밀도는 물보다 작기 때문이죠. 문제에서 질량과 부피가 나왔기 때문에 각 물질의 밀도를 계산할 수 있고, 물의 밀도가 1g/㎤ 이므로 물에 넣었을 때 가라앉는 것은 물의 밀도가 큰 물체를 찾으면 됩니다.
19번 문제
용해에 대한 문제입니다.

문제풀이
설탕과 물을 섞으면 설탕물이 되죠. 이때 설탕이 물에 녹죠. 녹는 물질을 용질(설탕이 되겠죠?), 녹이는 물질을 용매(물이고요~), 설탕물을 용액, 녹이는 현상을 용해라고 합니다. 그럼 A, B, C, D 다 찾을 수 있겠죠? 설탕이 물에 녹으면 설탕이 안 보이죠. 이렇게 일정한 온도에서 용매 100g에 최대한 녹을 수 있는 용질의 양을 용해도 라고 하고, 최대한 녹은 상태의 용액을 포화 용액, 더 녹을 수 있는 상태를 불포화 용액이라고 합니다.
20번 문제
기체의 용해도 문제입니다.

문제풀이
용질이 고체나 액체인 경우 온도가 높을수록 잘 녹을 수 있죠. 그래서 용해도는 크다고 합니다. 하지만, 기체는 조금 달라요. 왜 기체입자들이 용매에 많이 녹으려면 입자들이 많이 모여 있어야 하는데, 기체 입자들은 매우 활발하게 움직이죠. 그래서 멀리 떨어져 있습니다. 멀리 떨어진 기체 입자들을 가까이하려면 온도를 낮추거나 압력을 크게 하면 되죠? 그러면 많이 모이게 되니까, 기체 입자들을 용매에 많이 녹일 수 있습니다. 따라서 기체의 용해도는 압력이 크거나 온도가 낮을 때 증가합니다. 그림에서 온도에 따른 기체의 용해도를 비교할 때는 A, C, E 세 개의 시험관을 비교하고, 압력에 따른 기체의 용해도를 비교할 때는 A, B처럼 온도는 같고, 압력이 다른 상태를 비교해야 하죠. 참고로 뚜껑을 덮은 시험관의 압력이 크다고 보시면 됩니다.
기체의 용해도는 어떻게 비교할까요? 시험관에 있는 기포수로 비교하면 됩니다. 탄산음료 안에는 이산화탄소 기체가 녹아 있습니다. 만약 용해도가 작으면 이산화탄소 기체가 녹지 않을 것이고, 밖으로 빠져나오겠죠? 어떻게 빠져나올까요? 바로 기포로 나타나게 됩니다. 따라서 기포가 많다는 것은 이산화탄소 기체가 많이 녹지 않았다고 보시면 됩니다.
21번 문제
용해도 곡선 문제입니다.

문제풀이
ㄱ - 고체의 용해도는 온도가 높을수록 증가하죠. 그래프에서 온도가 높을수록 용해도가 증가하는 것을 알 수 있습니다.
ㄴ - 20 ℃에서 황산 구리(2)의 용해도는 20이다. - 그래프를 참조하세요^^
ㄷ - 40 ℃ 물 200g에 질산칼륨은 최대 63g 녹을 수 있다. - 용해도는 용매 100g 기준입니다. 문제에서 용매는 물이네요. 용해도는 일정 온도일 때 물 100g에 용질이 최대한 녹을 수 있는 양으로, 그림에서 40 ℃ 물 100g에 질산칼륨은 60g까지 녹일 수 있습니다. 문제처럼 물이 100g이 아닌 200g이라면 질산칼륨은 최대 녹을 수 있는 양은 물 100g일 때 녹을 수 있는 양의 2배 하시면 됩니다. 왜? 용매가 늘어나면 녹을 수 있는 용질도 같이 늘어납니다. 간단하게 컵에 물 10g을 넣었을 때 설탕이 녹는 양과 컵에 물 100g을 넣었을 때 설탕이 녹는 양은 다르죠? 어느 쪽이 더 많이 녹을 수 있을까요? 물 100g입니다. 따라서 물 200g에 녹을 수 있는 질산칼륨의 양은 용해도의 2배가 됩니다.
22번 문제
용해도 계산 문제입니다.

문제풀이
21번 ㄷ을 참조하시면 답이 보여요~~
23번 문제
혼합물 가열 곡선에 대한 문제입니다.

문제풀이
액체 혼합물을 가열하면 온도가 일정한 구간의 개수에 따라서 혼합물의 들어 있는 물질의 개수를 알 수 있습니다. 그림에서 온도가 일정한 구간이 2개이므로 액체 혼합물에 들어 있는 순물질의 개수는 2개입니다.
ㄱ. 액체 혼합물을 가열한 것이기 때문에 액화가 아니겠죠?
ㄴ. 나) 구간에서 온도가 일정한 까닭은 나) 구에서 나오는 물질이 상태변화를 하고 있기 때문이지, 가열을 멈춘 것은 아니겠죠?
ㄷ. 라) 구간에서 나오는 기체는 한 종류의 물질인 순물질 이므로 기체를 모아서 냉각하면 순수한 액체를 얻을 수 있습니다.
24번 문제
혼합물 분리에 대한 문제입니다.
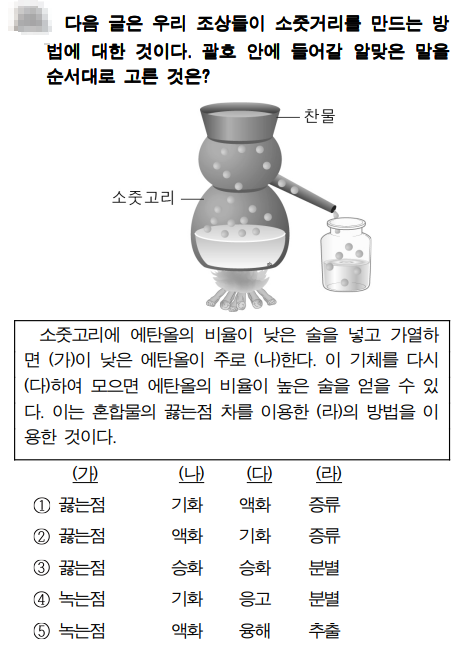
문제풀이
소줏고리는 우리 선소들이 청주를 만들기 위해 만든 기구입니다. 탁주를 만들어서 소줏고리에 넣고 끓이면 알코올의 끓는점이 물보다 낮기 때문에 알코올이 먼저 끓게 됩니다. 이때 나온 알코올을 모아서 냉각시키면 순수한 알코올을 얻을 수 있습니다. 이런 혼합물의 분리를 증류라고 합니다.
이상 2학기 과학 중간고사 기출문제 풀이를 했습니다. 여기에서 안 나온 문제도 있는데, 궁금한 것이 있으면 댓글이나 네이버 지식인에서 '과외하는 아빠'를 검색하셔서 질문을 하시면 제가 아는 범위에서 답변을 하겠습니다.^^
<정답>
17-2, 18-1.4, 19-4, 20-2, 21-3, 22-5, 23-3, 24-1
'중등과학문제' 카테고리의 다른 글
| 중3 과학 7단원 별의 거리 및 밝기 예상문제 풀이 (2) | 2023.11.06 |
|---|---|
| 중3 7단원 별의 거리 기출문제 풀이 (1) | 2023.10.27 |
| 중2 과학 2학기 중간고사 기출문제 풀이 -3 (3) | 2023.10.12 |
| 중2 과학 2학기 중간고사 기출문제 풀이 -2 (5) | 2023.10.11 |
| 중2 과학 2학기 중간고사 기출문제 풀이 -1 (5) | 2023.10.10 |


